题目内容
18.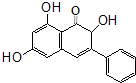 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
分析 有机物含有酚羟基、羰基、羟基和碳碳双键,结合苯酚、酮、醇以及烯烃的性质解答该题.
解答 解:A.由结构简式可知高良姜素的分子式为C15H12O5,故A错误;
B.分子含有两个苯环,只有1个碳碳双键,故B错误;
C.含有酚羟基,可与碳酸钠溶液反应、溴水反应,含有碳碳双键,可与溴水发生加成反应,可被酸性高锰酸钾氧化,故C正确;
D.含有3个羟基,但生成氢气存在的外界条件未知,不能确定体积大小,故D错误.
故选C.
点评 本题考查有机物的结构和性质,侧重于有机物的组成、结构和性质的考查,注意有机物空间结构特点的判断,把握有机物的官能团的种类和性质,为解答该题的关键,易错点为D,注意气体存在的外界条件的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8. ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
(1)仪器a名称是圆底烧瓶.装置A中反应的化学方程式为2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O.用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是二氧化氯被二氧化碳稀释,可防止二氧化氯爆炸.
(2)装置C的作用是防止倒吸,装置B中用冰水浴的目的是冷凝并分离出二氧化氯.
(3)工业上生产HClO4和NaClO2的工艺流程如图所示.

①操作2的名称是蒸馏;
②设计简单实验证明HClO2为弱酸:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸.
(4)ClO2很不稳定,需用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mLClO2溶液于锥形瓶中.
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol•L-1•的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
实验中加入的指示剂是淀粉溶液,达到滴定终点时的现象是溶液由蓝色变为无色,且保持30s不变.
原溶液中ClO2的含量为$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示)g•L-1.(已知:2ClO2+8H++10I-═2Cl-+5I2+4H2,2S2O32-+I2═2I-+S2O32-)
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |
(2)装置C的作用是防止倒吸,装置B中用冰水浴的目的是冷凝并分离出二氧化氯.
(3)工业上生产HClO4和NaClO2的工艺流程如图所示.

①操作2的名称是蒸馏;
②设计简单实验证明HClO2为弱酸:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸.
(4)ClO2很不稳定,需用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mLClO2溶液于锥形瓶中.
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol•L-1•的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
实验中加入的指示剂是淀粉溶液,达到滴定终点时的现象是溶液由蓝色变为无色,且保持30s不变.
原溶液中ClO2的含量为$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示)g•L-1.(已知:2ClO2+8H++10I-═2Cl-+5I2+4H2,2S2O32-+I2═2I-+S2O32-)
9.在密闭容器中盛有H2、O2、Cl2三种气体,电火花点燃后,三种气体都正好反应完全,冷却到室温,所得溶液的质量分数为25.26%,则原混合气体中三者的分子个数之比为( )
| A. | 15:8:1 | B. | 13:6:1 | C. | 9:6:1 | D. | 6:3:1 |
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
13.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩
(3)已知:
工业制镁时的反应方程式是MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;制铝时,电解Al2O3不电解AlCl3的原因是熔融状态下氯化铝以分子存在,不导电,所以用电解熔融氧化铝的方法冶炼.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的b:
a. NH3 b. HI c. SO2 d. CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式:
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的b:
a. NH3 b. HI c. SO2 d. CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
3.使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H
副反应及773K时平衡常数如表所示
(1)主反应△H=-1632.5kJ•mol-1,773K时主反应平衡常数K=4.6×1043L•mol-1
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.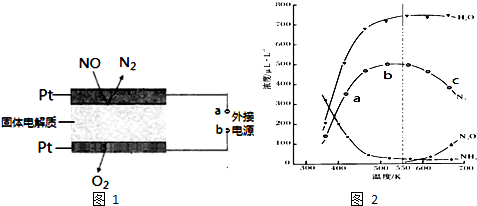
A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H副反应及773K时平衡常数如表所示
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.

A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
7.下列有关溶液组成的描述合理的是( )
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
8.用32gCu与300mL12mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是( )
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |