题目内容
15.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
分析 Al分别与足量稀盐酸、NaOH溶液反应生成相同条件下的同体积氢气,Al和稀盐酸、NaOH溶液反应方程式分别为2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算.
解答 解:Al和稀盐酸、NaOH溶液反应方程式分别为2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al与足量稀盐酸、NaOH溶液反应时生成相同条件下的同体积氢气,说明生成氢气的物质的量相等,假设都是生成3mol氢气,消耗稀盐酸6mol、消耗NaOH溶液2mol,所以反应中消耗的HCl和NaOH的物质的量之比=6mol:2mol=3:1,故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确书写方程式是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)?A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )
| A. | 反应速率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 | ||
| C. | 平衡时C的转化率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
3.使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H
副反应及773K时平衡常数如表所示
(1)主反应△H=-1632.5kJ•mol-1,773K时主反应平衡常数K=4.6×1043L•mol-1
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.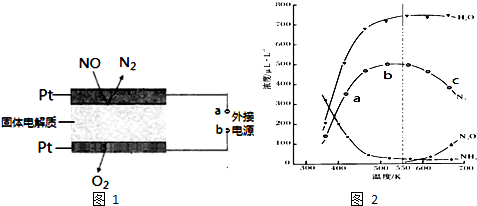
A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H副反应及773K时平衡常数如表所示
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.

A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
20.下列电解质在溶解或熔化时,没有电离出Cl-的是( )
| A. | 盐酸 | B. | 熔化的氯化钠 | C. | KClO3溶液 | D. | NaCl溶液 |
7.下列有关溶液组成的描述合理的是( )
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
4.如图,反应2X(g)+Y(g)?2Z(g)△H<0,下列分析不正确的是( )
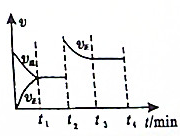

| A. | t2可能是升高温度 | |
| B. | t1时刻Y的体积分数可能比t3时刻Y的体积分数小 | |
| C. | t1时刻X的浓度可能比t3时刻X的浓度大 | |
| D. | t1时的平衡是从逆反应方向建立 |
5.四种短周期元素a、b、c、d在周期表中的位置关系如表所示,下列有关a、b、c、d四种元素的叙述中正确的是( )
| ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| a | b | |||
| c | d |
| A. | a的氢化物水溶液显酸性 | |
| B. | 在这4种元素中,b的氢化物热稳定性最好 | |
| C. | c的氧化物是碱性氧化物 | |
| D. | d的氧化物对应水化物一定是强酸 |