题目内容
3.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如图: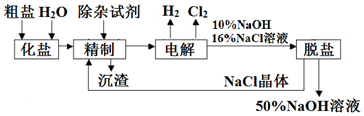
依据图,完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,使用的试剂有:①Na2CO3溶液;②Ba(OH)2溶液;③稀盐酸,其合理的加入顺序为②①③(填序号);
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却结晶、过滤除去NaCl(填写操作名称);
(4)隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,以防止Cl2与NaOH反应;若采用无隔膜电解冷的食盐水,产物仅是NaClO和H2,则相应的化学方程式为NaCl+H2O═H2↑+NaClO;
(5)Cl2和新型消毒剂ClO2都可用于自来水的消毒杀菌,若它们在消毒杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为5:2.
分析 (1)电解精制饱和食盐水生成氯气、氢气、烧碱;
(2)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(3)经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升.当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl,获得的NaCl可循环使用,据此进行解答;
(4)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水;
(5)根据得到相同电子数需要各物质的物质的量来解题.
解答 解:(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和Ba(OH)2溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,最后加入盐酸,所以加入试剂合理的顺序为②①③,
故答案为:②①③;
(3)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、过滤;
故答案为:蒸发浓缩;过滤;
(4)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水,整个过程发生的反应是:NaCl+H2O═H2↑+NaClO;故答案为:NaCl+H2O═H2↑+NaClO;
(5)因一个ClO2转变成Cl-需要得到10个电子,而一个Cl2转变成Cl-需要得到10个电子,消毒等量的自来水,根据转移电子数相等,所需Cl2和ClO2的物质的量之比为5:2,故答案为:5:2.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.

| A. | Fe | B. | Mg | C. | Cu | D. | Ag |
| A. | C4H10和C20H42 | B. | 邻二甲苯和对二甲苯 | ||
| C. | C4H8O2和C3H6O2 | D. | 一溴乙烷和1,2-二溴乙烷 |
| A. | 钠熔法可定性确定有机物中是否存在氮、氯等元素,将有机样品与金属钠混合熔融,氮、氯将以硝酸钠、氯化钠的形式存在 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则b>c>a>d | |
| D. | 等质量的烃完全燃烧,耗氧量最多的是甲烷 |
| A. | 32g/mol | B. | 165g/mol | C. | 55g/mol | D. | 100g/mol |
| A. | 氯乙烯的结构简式:CH2CHCl | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 苯的结构式: | D. | 羟基的电子式: |
| A. | 1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol O3和1.5 mol O2含有相等的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸溶液和盐酸,含有的氢元素质量之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含的碳原子数之比为1:6,氧原子数之比为1:3 |
| A. | 称取3.55g硫酸钠,加入250mL水 | |
| B. | 称取2.84g硫酸钠,加水配成250mL溶液 | |
| C. | 称取6.44g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 | |
| D. | 称取8.05g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 |
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |