题目内容
11.下列说法中正确的是( )| A. | 钠熔法可定性确定有机物中是否存在氮、氯等元素,将有机样品与金属钠混合熔融,氮、氯将以硝酸钠、氯化钠的形式存在 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则b>c>a>d | |
| D. | 等质量的烃完全燃烧,耗氧量最多的是甲烷 |
分析 A.钠具有强的还原性,与N、Cl、Br、S等元素与金属钠混合熔融,得到的是低价态化合物,据此解答;
B.单烯烃与HBr加成反应的产物只有一种结构,说明结构对称;
C.键能越大,键长越短,键能:碳碳三键>碳碳双键>碳碳单键;
D.等质量的烃完全燃烧,烃中氢元素的质量分数越大,耗氧量越高.
解答 解:A.钠具有强的还原性,与N、Cl、Br、S等元素与金属钠混合熔融,得到的是低价态化合物,所以不能得到硝酸钠,故A错误;
B.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有:CH2=CH2、CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、CH3CH2CH2CH=CHCH2CH2CH3、C(CH3)2=C(CH3)2、CH3CH2C(CH3)=C(CH3)CH2CH3、CH3CH(CH3)CH=CHCH(CH3)CH3等,共7种,故B错误;
C.键能越大,键长越短,键能:碳碳三键>碳碳双键>碳碳单键,苯中的化学键键能介于单键与双键之间,所以键长:b>a>c>d,故C错误;
D.等质量的烃完全燃烧,烃中氢元素的质量分数越大,耗氧量越高,所有的烃中H元素的质量分数最大的是甲烷,所以耗氧量最多的是甲烷,故D正确.
故选D.
点评 本题考查了有机物中元素的测定、同分异构体、键能与键长的判断、燃烧规律,题目涉及的知识点较多,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 向氯水中加食盐不利于氯气的溶解 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 高压有利于合成氨的反应 |
19.“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于( )
| A. | 金属材料 | B. | 无机非金属材料 | ||
| C. | 有机高分子材料 | D. | 传统无机非金属材料 |
6.在25℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g•cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
| A. | 溶质的质量分数为ω=$\frac{a}{ρV}$×100% | |
| B. | 溶质的物质的量浓度c=17 V/1 000 a mol•L-1 | |
| C. | 溶液中c(OH-)=V/1 000b mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω |
16.在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
20.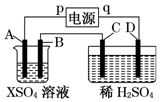 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
仔细分析以上实验数据,请说出变化的可能原因是开始时C、D两极气体体积比为1:3,10分钟时约为1:2,说明开始时氧气溶解于溶液中.
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
8.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
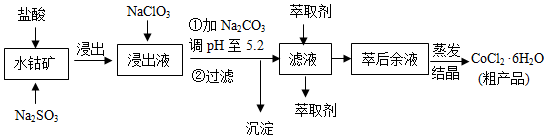
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
 .
.