题目内容
12.实验室里需用200mL 0.1mol/L的硫酸钠溶液,现利用容量瓶进行配制,以下操作方法正确的是( )| A. | 称取3.55g硫酸钠,加入250mL水 | |
| B. | 称取2.84g硫酸钠,加水配成250mL溶液 | |
| C. | 称取6.44g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 | |
| D. | 称取8.05g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 |
分析 需用200mL 0.1mol•L-1的硫酸钠溶液,要配制250ml 0.1mol•L-1的硫酸钠溶液,溶液中硫酸钠的物质的量为0.25L×0.1mol•L-1=0.025mol,需要称取硫酸Na的质量为0.025mol×142g/mol=3.55g,如称取硫酸钠晶体,则质量为0.025mol×322g/mol=8.05g,以此解答.
解答 解:A.称取3.55g硫酸钠,加入250mL水,最后溶液的体积不是250mL,水的体积不等于溶液的体积,故A错误;
B.需要称取3.55g硫酸钠,加水配成250mL溶液,故B错误;
C.称取硫酸钠晶体,则质量为0.025mol×322g/mol=8.05g,故C错误;
D.硫酸钠晶体(Na2SO4•10H2O),质量为0.025mol×322g/mol=8.05g,加水配成250ml溶液,符合实验操作,故D正确.
故选D.
点评 本题考查一定物质的量浓度的溶液的配制,本题难度不大,注意硫酸铜和胆矾的区别,另外注意水的体积不等于溶液的体积.

练习册系列答案
相关题目
20.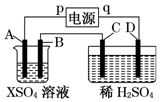 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
仔细分析以上实验数据,请说出变化的可能原因是开始时C、D两极气体体积比为1:3,10分钟时约为1:2,说明开始时氧气溶解于溶液中.
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,36g 水中所含的氧原子数目为2NA | |
| B. | 在标准状况下,22.4L三氧化硫的物质的量是1mol | |
| C. | 在标准状况下,0.1mol四氯化碳的体积为2.24L | |
| D. | 在标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
17.(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验.
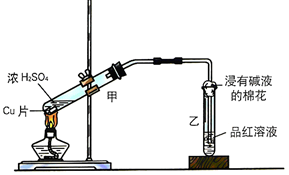
①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.
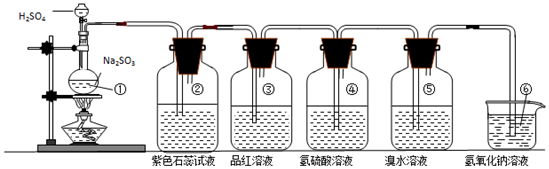
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:

①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.

(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
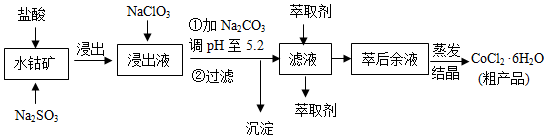
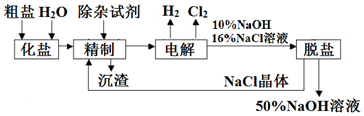
8.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
 .
.
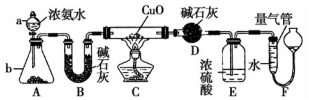 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题: