题目内容
17.有A、B、C、D、E五种金属元素,在相同的条件下,B的最高价氧化物对应的水化物的碱性比A的最高价氧化物对应的水化物的碱性强,A、B都可以从盐溶液中置换出C;D与冷水剧烈反应并放出氢气,A、B、C、E四种金属分别投入到盐酸中,只有E不放出氢气,则这五种金属元素的金属性由强到弱的顺序为D>B>A>C>E.分析 元素的金属性越强,则对应的元素的最高价氧化物对应水化物的碱性越强,在相同条件下,B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强,则金属性:B>A;A、B可以从C的盐溶液中置换出C,说明金属A、B比C活泼,金属性B>A>C,D单质可以与冷水剧烈反应并放出氢气,说明D元素的金属性非常强,应是五种元素中金属性最强的元素;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气,说明E最不活泼,金属性最弱,以此解答该题.
解答 解:元素的金属性越强,则对应的元素的最高价氧化物对应水化物的碱性越强,在相同条件下,B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强,则金属性:B>A;A、B可以从C的盐溶液中置换出C,说明金属A、B比C活泼,金属性B>A>C,D单质可以与冷水剧烈反应并放出氢气,说明D元素的金属性非常强,应是五种元素中金属性最强的元素;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气,说明E最不活泼,金属性最弱,则有五种金属元素的金属性由强到弱的顺序为D>B>A>C>E,故答案为:D>B>A>C>E.
点评 本题考查金属性的比较,题目难度不大,本题注意比较金属性强弱的角度和方法,特别是D,可以与冷水剧烈反应并放出氢气,说明D元素的金属性非常强.

练习册系列答案
相关题目
7.下列检验Na2SO4溶液中是否含有Cl-的方法,正确的是( )
| A. | 先加BaCl2溶液,过滤后在滤液中再加AgNO3溶液 | |
| B. | 先加足量的Ba(NO3)2溶液,过滤后在滤液中再加AgNO3溶液和硝酸溶液 | |
| C. | 先加AgNO3溶液,过滤后,在沉淀中再加稀硝酸 | |
| D. | 先加足量的Ba(OH)2溶液,过滤后在滤液中再加AgNO3溶液 |
8.下列离子方程式不正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO | |
| D. | 甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
5.下列反应中,最终一定有白色沉淀生成的是( )
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②向Na2CO3溶液中加入酸化的CaCl2溶液;③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸;④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②向Na2CO3溶液中加入酸化的CaCl2溶液;③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸;④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
| A. | ①④ | B. | ①②③④ | C. | ③④ | D. | ①③④ |
2.下列各组离子在溶液中能大量共存的是( )
| A. | Na+、H+、Ba2+、CO32- | B. | K+、Na+、Ag+、Cl- | ||
| C. | H+、Mg2+、HCO3-、SO42- | D. | Ba2+、Cl-、NO3-、OH- |
6.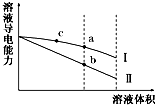 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
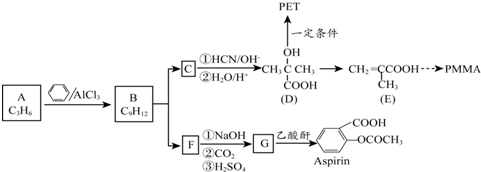
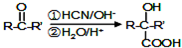
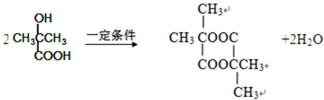 .1mol Aspirin分子与足量的NaOH反应的化学方程式是
.1mol Aspirin分子与足量的NaOH反应的化学方程式是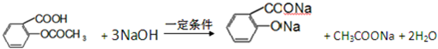 .
.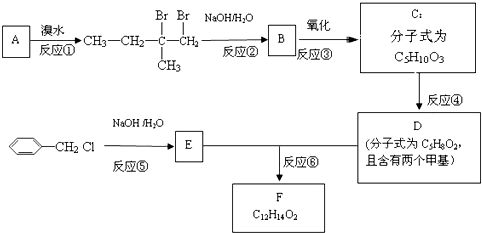
 .
.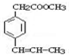 是F的一种同分异构体,属于芳香族化合物
是F的一种同分异构体,属于芳香族化合物