题目内容
2.下列各组离子在溶液中能大量共存的是( )| A. | Na+、H+、Ba2+、CO32- | B. | K+、Na+、Ag+、Cl- | ||
| C. | H+、Mg2+、HCO3-、SO42- | D. | Ba2+、Cl-、NO3-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.H+、Ba2+分别与CO32-反应,不能大量共存,故A不选;
B.Ag+、Cl-结合生成沉淀,不能大量共存,故B不选;
C.H+、HCO3-结合生成水和气体,不能大量共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
12.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下表:
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
13.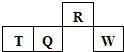 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐T可以出现在酸根中 |
7.某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
11.下列属于吸热反应的是( )
| A. | 酸碱中和 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
12.下列有关离子检验的叙述正确的是( )
| 选项 | 操作及现象 | 结论 |
| A | 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解 | 溶液中含有Ag+或SO42- |
| B | 取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色 | 溶液中含有Br- |
| C | 取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝 | 溶液中含有NH4+ |
| D | 取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |

 .
.