题目内容
7.下列检验Na2SO4溶液中是否含有Cl-的方法,正确的是( )| A. | 先加BaCl2溶液,过滤后在滤液中再加AgNO3溶液 | |
| B. | 先加足量的Ba(NO3)2溶液,过滤后在滤液中再加AgNO3溶液和硝酸溶液 | |
| C. | 先加AgNO3溶液,过滤后,在沉淀中再加稀硝酸 | |
| D. | 先加足量的Ba(OH)2溶液,过滤后在滤液中再加AgNO3溶液 |
分析 检验Na2SO4溶液中是否含有Cl-的方法,应先加硝酸钡排除硫酸根离子的干扰,过滤后加硝酸、硝酸银检验氯离子,以此来解答.
解答 解:A.先加BaCl2溶液,引入氯离子,不能检验原溶液中是否含氯离子,故A错误;
B.先加足量的Ba(NO3)2溶液,除去硫酸根离子,过滤后在滤液中再加AgNO3溶液和硝酸溶液,生成白色沉淀可检验,故B正确;
C.先加AgNO3溶液,硫酸根离子、氯离子均反应,不能检验,故C错误;
D.先加足量的Ba(OH)2溶液,滤液中含NaOH与硝酸银反应,干扰氯离子的检验,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应及现象、离子的检验方法为解答的关键,侧重分析与应用能力的考查,注意检验中应排除干扰离子,题目难度不大.

练习册系列答案
相关题目
18.检验某溶液中是否含有 K+、Fe3+、Cl-、Mg2+、I-、CO32-、SO42-,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( )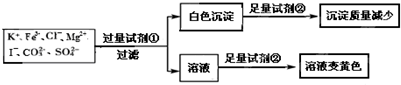

| A. | 试剂①为硝酸钡 | |
| B. | 试剂②一定为盐酸 | |
| C. | 该溶液中一定有 I-、CO32-、SO42-、K+ | |
| D. | 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- |
2.常温下由CO、H2和O2组成的混合气体,测得该混合气体对氢气的相对密度为14,则原混合气体中CO、H2和O2的体积比为( )
| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
12.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下表:
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
19.一定质量的有机物A与足量金属钠反应,可得V1升气体.等质量的A与足量的碳酸氢钠溶液反应,可得V2升气体.如果在同温同压下,V1=V2,则A可能是下列物质中的( )
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
16.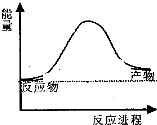 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如表所示:
则该反应吸收或放出热量为4a+4b-2c-4dkJ(用含a b c d字母的代数式表示)
 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)若已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |