题目内容
6.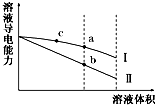 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
分析 稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,加水稀释时,醋酸进一步电离,所以稀释过程中,醋酸导电能力大于盐酸,则Ⅰ为醋酸稀释曲线,Ⅱ为盐酸稀释曲线,据此回答判断即可.
解答 解:A.稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,故A错误;
B.导电能力越大,说明离子浓度越大,酸性越强,则a、b、c三点溶液的pH大小顺序为b<a<c,故B错误;
C.相同温度下,Kw相同,故C错误;
D.C点离子浓度大于a点离子浓度,溶液离子浓度越大,氢离子浓度就越大,对水的电离抑制程度越大,则c点水电离的H+物质的量浓度小于a点水电离的H+物质的量浓度,故D正确.
故选D.
点评 本题考查弱电解质的电离,注意溶液离子浓度与导电性之间的关系是解本题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.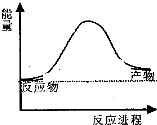 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如表所示:
则该反应吸收或放出热量为4a+4b-2c-4dkJ(用含a b c d字母的代数式表示)
 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)若已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
11.下列属于吸热反应的是( )
| A. | 酸碱中和 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
18.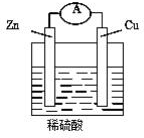 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |