题目内容
9.SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅.(1)写出工业上制备粗硅的化学反应方程式SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
(2)SiO2耐腐蚀,但易溶于氢氟酸,写出化学反应方程式:SiO2+4HF=SiF4↑+2H2O
(3)实验室盛装氢氧化钠的试剂瓶用橡皮塞而不用玻璃塞,这是为了防止发生反应:SiO2+2NaOH=Na2SiO3+H2O.
分析 (1)碳能与二氧化硅反应生成硅单质;
(2)二氧化硅能与氢氟酸反应生成四氟化硅气体;
(3)在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起.
解答 解:(1)工业上制备粗硅是利用碳能与二氧化硅反应生成硅单质,化学反应方程式:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑;
(2)二氧化硅能与氢氟酸反应生成四氟化硅气体,化学反应方程式:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)玻璃塞中含有二氧化硅,在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物硅酸钠有粘性,使瓶口与瓶塞粘合在一起,反应的方程式为:SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
点评 本题考查化学方程式的书写,题目难度不大,注意把握硅和二氧化硅的性质,注意知识的积累.

练习册系列答案
相关题目
19.一定质量的有机物A与足量金属钠反应,可得V1升气体.等质量的A与足量的碳酸氢钠溶液反应,可得V2升气体.如果在同温同压下,V1=V2,则A可能是下列物质中的( )
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
4.A、B、C是元素周期表中相邻的三种元素,A和B同周期,B和C同主族,三种元素原子最外层电子数之和为14,核内质子数之和为28,则A、B、C三种元素分别是( )
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
18.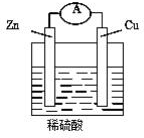 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |