题目内容
5.下列反应中,最终一定有白色沉淀生成的是( )①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②向Na2CO3溶液中加入酸化的CaCl2溶液;③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸;④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
| A. | ①④ | B. | ①②③④ | C. | ③④ | D. | ①③④ |
分析 ①向久置的Na2SO3溶液中含硫酸根离子;
②酸化溶液中含氢离子,与碳酸钠反应生成气体;
③向Na2SO3溶液中通入Cl2,发生氧化还原反应生成硫酸根离子;
④向Na2SO3溶液中加入稀HNO3后,发生氧化反应生成硫酸根离子.
解答 解:①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸,生成硫酸钡白色沉淀,故选;
②向Na2CO3溶液中加入酸化的CaCl2溶液,不生沉淀,故不选;
③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸,生成硫酸钡白色沉淀,故选;
④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液,生成硫酸钡白色沉淀,故选;
故选D.
点评 本题考查物质的性质,为高频考点,把握物质性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.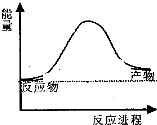 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如表所示:
则该反应吸收或放出热量为4a+4b-2c-4dkJ(用含a b c d字母的代数式表示)
 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)若已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
13.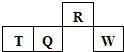 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐T可以出现在酸根中 |
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.

 .
.