题目内容
10.某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO,从该矿石中提取钴的主要流程如下: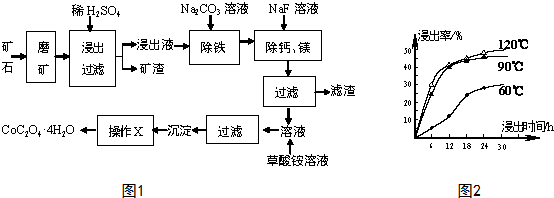
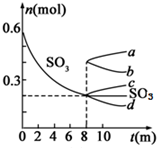
(1)在一定浓度的H2SO4 溶液中,钴的浸出率随时间、温度的变化如图所示.考虑生产成本和效率,最佳的浸泡时间为12h,最佳的浸出温度为90℃.
(2)请配平下列除铁的化学方程式:
□Fe2(SO4)3+□H2O+□Na2CO3═□Na2SO4+□CO2↑+□Na2Fe6(SO4)4(OH)12↓
(3)“除钙、镁”的反应原理如下:
MgSO4+2NaF═MgF2↓+Na2SO4 CaSO4+2NaF═CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10、Ksp(MgF2)=7.40×10-11,加入过量NaF 溶液反应完全后过滤,则滤液中的$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=1.5.
(4)“沉淀”表面吸附的主要离子有SO42-、NH4+、Na+、F-;“操作X”名称为洗涤、干燥.
(5)某锂离子电池正极是LiCoO2,以含Li+的导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6 中,电池反应为:LiCoO2+C6$?_{放电}^{充电}$ CoO2+LiC6.LiC6 中Li 的化合价为0价.若放电时有1mol e-转移,正极质量增加7g.
分析 水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据浸出率与时间和温度的关系及生产成本分析;
(2)根据原子守恒配平方程式;
(3)$\frac{c(Ca{\;}^{2+})}{c(Mg{\;}^{2+})}$=$\frac{Ksp(CaF{\;}_{2})}{Ksp(MgF{\;}_{2})}$;
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,依据负极电极材料和题干信息分析计算.
解答 解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时,最佳的浸出温度为90℃,
故答案为:12;90;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,
故答案为:3,6,6,1,5,6;
(3)$\frac{c(Ca{\;}^{2+})}{c(Mg{\;}^{2+})}$=$\frac{Ksp(CaF{\;}_{2})}{Ksp(MgF{\;}_{2})}$=$\frac{1.1×10{\;}^{-10}}{7.40×10{\;}^{-11}}$=1.5,
故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有SO42-、NH4+、Na+、F-,所以沉淀上含有SO42-、NH4+、Na+、F-,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,
故答案为:SO42-、NH4+、Na+、F-;洗涤、干燥;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以负极为LiC6中Li的化合价为0价,若放电时有1mol e-转移,CoO2+Li++e-=LiCoO2,正极质量增加为1molLi+的质量=1mol×7g/mol=7g;
故答案为:0;7.
点评 本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.

| A. | HNO3 | B. | Cu | C. | SO2 | D. | NH4NO3 |
| A. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、HS-、SO42- | |
| B. | 使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- | |
| C. | 由水电离出的c(H+)=10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
| A. | ① | B. | ①② | C. | ①③ | D. | ①③④ |
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.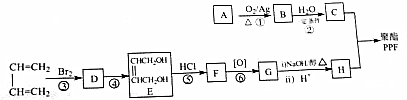

 .
. .
.