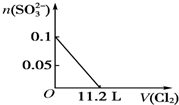
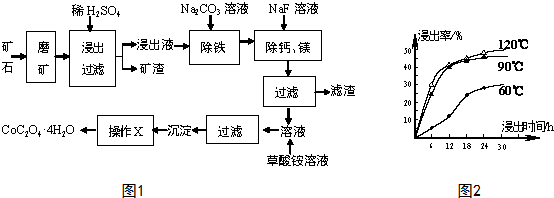
题目内容
5.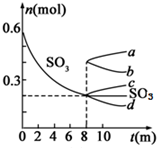 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.(1)T1℃时,反应2SO2(g)+O2(g)?2SO3(g) (△H<0)在8分钟时达到平衡;若其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为c(填字母).
(2)如表为不同温度(T)下该反应的化学平衡常数(K),由此推知,温度最低的是T2(填“T1”、“T2”或“T3)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
分析 (1)其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大;
(2)根据反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大来分析.
解答 解:(1)在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大,即为图象c,
故答案为:c;
(2)因为反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大,所以温度最低的为K最大的,即T2,故答案为:T2.
点评 本题考查了化学平衡的有关知识,图象变化的分析,外界条件对化学平衡的影响,试题较灵活,综合性强,难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.现有下列反应式,据两式判断,下列各组离子中,氧化性由强到弱的排列顺序正确的是
(1)2Fe3++2I-═2Fe2++I2 (2)Br2+2Fe2+═2Fe3++2Br-( )
(1)2Fe3++2I-═2Fe2++I2 (2)Br2+2Fe2+═2Fe3++2Br-( )
| A. | Br2>Fe2+>I2 | B. | Br2>Fe3+>I2 | C. | I2>Br2>Fe3+ | D. | Fe3+>Br2>I2 |
13.下列化学式对应的结构式从成键情况看不合理的是( )
| A. |  | B. |  | C. |  | D. |  |
20.将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则关于杂质成分的推测不合理的是( )
| A. | NaNO3 | B. | Mg(NO3)2 | ||
| C. | AgNO3 | D. | NaNO3和AgNO3的混合物 |
17.已知氮的氧化物跟NaOH溶液发生的化学反应如下:3NO2+2NaOH═2NaNO3+NO↑+H2O,NO2+NO+2NaOH═2NaNO2+H2O现有m mol NO2和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol/L的NaOH溶液,则需此NaOH溶液的体积是( )
| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
14.近一个月济宁地区的空气污染指数居高不下,雾霾天气严重,据分析霾中含有硫和氮的氧化物,如SO2、NOx等.
(1)NOx是汽车尾气中的主要污染物之一.
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO.
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨.取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是:2H2SO3+O2=2H2SO4(用化学方程式表示).
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是CaSO4.
②下列物质中,可用于吸收烟气中的SO2的是ad(填序号).
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3•H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
根据表中数据计算:a=1×10-4mol/L.
(1)NOx是汽车尾气中的主要污染物之一.
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO.
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨.取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是:2H2SO3+O2=2H2SO4(用化学方程式表示).
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是CaSO4.
②下列物质中,可用于吸收烟气中的SO2的是ad(填序号).
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3•H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
17.下列有机反应中,不属于取代反应的是( )
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 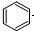 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$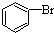 +HBr +HBr |