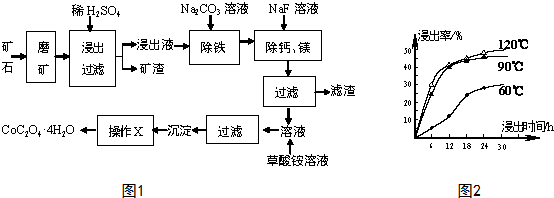
题目内容
15.已知下列热化学方程式:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
分析 由盖斯定律:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol,则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-(1)+2(2)+(3)即得,由此分析解答.
解答 解:由盖斯定律:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol,则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=870.3kJ/mol+2×(-393.5kJ/mol)+(-571.6kJ/mol)=-488.3 kJ/mol,
故选A.
点评 本题考查学生利用盖斯定律计算反应热,题目难度不大,关键在于设计反应过程,构造出目标反应式.

练习册系列答案
相关题目
6.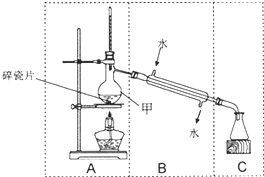 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.
(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
| A.除去CO2气体中混有的少量HCl气体 |
| B.从硝酸钾和氯化钠的混合物中提纯得到硝酸钾 |
| C.用含有Fe3+的自来水获得少量纯净的水 |
3.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
20.向100mL由等物质的量的FeBr2和FeI2配成的混合溶液中,缓慢通入氯气3.36L(标准状况),反应完全后,溶液中有一半的Fe2+被氧化成Fe3+,则原混合液中FeI2的物质的量浓度为( )
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
7.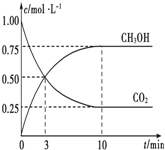 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
7.NA代表阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:Fe---56)( )
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
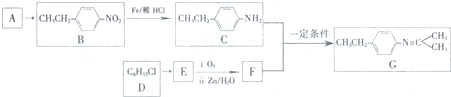
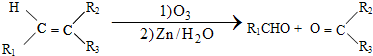
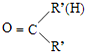 $\stackrel{一定条件}{→}$R-N=C
$\stackrel{一定条件}{→}$R-N=C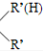 +H2O
+H2O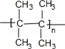 .
.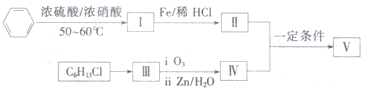
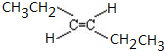 .
.