题目内容
20.数据分析能力是新课程对中学生提出的一项要求.表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见表:| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
分析 (1)第4、5、6次生成沉淀碳酸钡的质量都为3.940g,说明样品质量为2.072g时,Ba(OH)2已经完全反应,第1次、第2次样品的质量之比等于生成的沉淀质量之比为1:2;
(2)第4次实验中样品完全反应,令KHCO3和Na2CO3的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
(3)第4次实验中反应物恰好完全沉淀,可计算碱的浓度,再结合酸碱混合后pH=2可知酸过量,以此计算.
解答 解:(1)第4、5、6次生成沉淀碳酸钡的质量都为3.940g,说明样品质量为2.072g时,Ba(OH)2已经完全反应,第1次、第2次样品的质量之比等于生成的沉淀质量之比为1:2,则实验2中数据为0.985g×2=1.970g,
故答案为:1.970;
(2)第4次实验中样品完全反应,令KHCO3和Na2CO3的物质的量分别为xmol、ymol,
则$\left\{\begin{array}{l}{100x+106y=2.072}\\{x+y=\frac{3.940}{197}}\end{array}\right.$
解得x:y=2:3,
故答案为:2:3;
(3)由0.518:2.072=0.985:3.940可知第4次实验中反应物恰好完全沉淀,即有:
原0.5L Ba(OH)2溶液中:n(OH-)=2×$\frac{3.940g}{197g/mol}$=0.04mol,
c(OH-)=$\frac{0.04mol}{0.5L}$=0.08mol/L,
混合后溶液pH=2,则c(H+)=0.01mol/L,设盐酸的体积为VmL,则
$\frac{(0.05mol/L×V-0.08mol/L×0.05L)}{V+0.05}$=0.01mol/L,
解得V=112.5mL.
答:所加盐酸的体积为112.5mL.
点评 本题考查混合物的计算,为高频考点,把握表格数据的分析、质量的关系、原子守恒为解答的关键,侧重分析与计算能力的考查,注意第4次恰好完全反应,题目难度不大.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | Fe3+、NH4+、Cl-、I- | B. | Cu2+、Na+、Cl-、NO3- | ||
| C. | K+、HCO3-、OH-、Ba2+ | D. | K+、CO32-、NO3-、Al3+ |
①酸的浓度和体积;
②碱的浓度和体积;
③比热容;
④反应后溶液的质量;
⑤生成水的质量;
⑥前后温度的变化;
⑦操作所需时间.
| A. | ①②④⑥ | B. | ③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
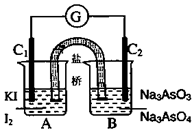 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是( )
| A. | 甲组操作过程中,C1做正极 | |
| B. | 乙组操作过程中,C2做负极,电极反应式为:AsO33-+2e-+2OH-=AsO43-+H2O | |
| C. | 两次操作过程中,微安表(G)指针的偏转方向相反 | |
| D. | 甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
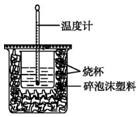 实验室利用如图装置进行中和热的测定.回答下列问题:
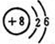
实验室利用如图装置进行中和热的测定.回答下列问题: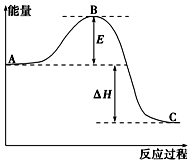 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.