题目内容
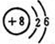
17.A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常用于自来水的杀菌消毒.请按要求填空:①A的原子结构示意图为:
②B的同位素中常用于制造氢弹的是:氘和氚
③用电子式表示B2A的形成过程
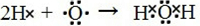
④写出实验室制取C的单质的化学方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 A、B、C三种短周期元素,A是地壳中含量最多的元素判断为氧元素,B的单质是最轻的气体为H2,C的单质通常情况下是一种黄绿色的气体判断为Cl2,该气体常用于自来水的杀菌消毒,
①A为氧原子核外电子数8,最外层6个电子;
②制造氢弹的元素为氘和氚;
③根据各种物质的类别判电子式的不同,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
④实验室制取氯气是利用二氧化锰和浓盐酸加热反应生成氯化镁、氯气和水;
解答 解:A、B、C三种短周期元素,A是地壳中含量最多的元素判断为氧元素,B的单质是最轻的气体为H2,C的单质通常情况下是一种黄绿色的气体该气体常用于自来水的杀菌消毒,判断为Cl2;
①A为氧元素,原子结构示意图为 ;
;
故答案为: ;
;
(2)B为H,氢元素的同位素中常用于制造氢弹的是氘和氚,
故答案为:氘和氚;
(3)用电子式表示B2A为H2O的形成过程为: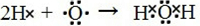 ;
;
故答案为: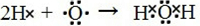 ;
;
(4)实验室制取Cl2的单质是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
点评 本题考查了根据元素在元素周期表中的位置及原子结构推断元素,注意化学用语的掌握,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
5.下列关于铁及其化合物的说法中正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下反应得产物为Fe2O3和H2 | |
| C. | 在空气中灼烧Fe(OH)3最终得到Fe2O3 | |
| D. | Cl2与过量的铁粉反应生成FeCl2 |
12.下列有关硫及其化合物的说法不正确的是( )
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
2.100mL 某混合液中HNO3的物质的量浓度为0.2mol/L,H2SO4 的物质的量浓度为0.1mol/L,向其中加入1.92g Cu,微热,完全反应后溶液中Cu2+的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
9.某学生探究如下实验(A):
(1)使淀粉变蓝的物质是I2.
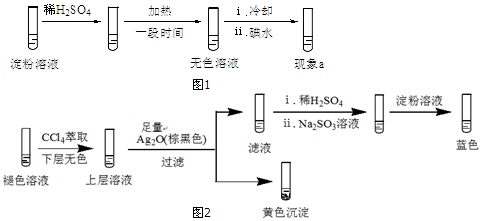
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.设计实验如图1,“现象a”证实该分析不合理:“现象a”是溶液不变蓝.
(3)再次分析:加热后单质碘发生了变化,实验如下:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-═I2+H2O.
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如图2实验:
①产生黄色沉淀的离子方程式是2H++2I-+Ag2O═2AgI↓+H2O.
②Ag2O的作用是证明上层溶液中存在I-,沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能.
③依据上述实验,推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.
| 实验A | 条件 | 现象 |
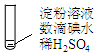 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.设计实验如图1,“现象a”证实该分析不合理:“现象a”是溶液不变蓝.
(3)再次分析:加热后单质碘发生了变化,实验如下:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-═I2+H2O.
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如图2实验:
①产生黄色沉淀的离子方程式是2H++2I-+Ag2O═2AgI↓+H2O.
②Ag2O的作用是证明上层溶液中存在I-,沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能.
③依据上述实验,推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.

6.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
20.数据分析能力是新课程对中学生提出的一项要求.表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见表:
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).



