题目内容
8.为了测定酸碱反应的中和热,计算时至少需要的数据是( )①酸的浓度和体积;
②碱的浓度和体积;
③比热容;
④反应后溶液的质量;
⑤生成水的质量;
⑥前后温度的变化;
⑦操作所需时间.
| A. | ①②④⑥ | B. | ③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
分析 根据中和热的计算公式△H=-$\frac{cm△T}{n}$来确定实验中需要的数据.
解答 解:由反应热的计算公式△H=-$\frac{cm△T}{n}$可知,酸碱反应的中和热计算时,至少需要的数据有:比热容c,酸的浓度和体积、碱的浓度和体积,反应前后温度变化△T,然后计算出反应后溶液的质量、生成水的物质的量,故选B.
点评 本题考查学生中和热的测定,比较基础,侧重对基础知识的巩固,注意对实验原理的理解掌握.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
5.下列关于铁及其化合物的说法中正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下反应得产物为Fe2O3和H2 | |
| C. | 在空气中灼烧Fe(OH)3最终得到Fe2O3 | |
| D. | Cl2与过量的铁粉反应生成FeCl2 |
6.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
16. 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
(1)非金属性最强的元素是F;
(2)化学性质最不活泼的单质是Ar;
(3)C和O中,原子半径较大的是C;
(4)某原子结构示意图为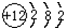 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;
(5)硫有两种重要氧化物,分别为SO2和SO3(填化学式);
(6)H2S和HCl中,热稳定性较强的是HCl;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是NaOH;属于两性氢氧化物的是Al(OH)3;
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式NH3,其水溶液显碱性(填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N):m(H)=7:1(相对原子质量:N一14 H-1)
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
(2)化学性质最不活泼的单质是Ar;
(3)C和O中,原子半径较大的是C;
(4)某原子结构示意图为
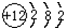 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;(5)硫有两种重要氧化物,分别为SO2和SO3(填化学式);
(6)H2S和HCl中,热稳定性较强的是HCl;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是NaOH;属于两性氢氧化物的是Al(OH)3;
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式NH3,其水溶液显碱性(填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N):m(H)=7:1(相对原子质量:N一14 H-1)
13.下列说法正确的是( )
| A. | 非金属元素组成的化合物中只可能含有共价键 | |
| B. | VIIA族元素气态氢化物的热稳定性从上到下依次减弱 | |
| C. | 第二周期元素原子的半径从左到右依次增大 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
20.数据分析能力是新课程对中学生提出的一项要求.表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见表:
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
 .
.