题目内容
5.9.03×1023个氨分子含4.5摩尔氢原子,15摩尔质子.分析 根据n=$\frac{N}{{N}_{A}}$计算出9.03×1023个氨分子的物质的量,然后计算出含有氢原子的物质的量及含有质子的物质的量.
解答 解:9.03×1023个氨分子的物质的量为:$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,含有H的物质的量为:1.5mol×3=4.5mol;
氨气分子中含有10个质子,则1.5mol氨气分子中含有质子的物质的量为:1.5mol×10=15mol,
故答案为:4.5;15.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
相关题目
2.100mL 某混合液中HNO3的物质的量浓度为0.2mol/L,H2SO4 的物质的量浓度为0.1mol/L,向其中加入1.92g Cu,微热,完全反应后溶液中Cu2+的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
16. 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
(1)非金属性最强的元素是F;
(2)化学性质最不活泼的单质是Ar;
(3)C和O中,原子半径较大的是C;
(4)某原子结构示意图为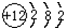 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;
(5)硫有两种重要氧化物,分别为SO2和SO3(填化学式);
(6)H2S和HCl中,热稳定性较强的是HCl;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是NaOH;属于两性氢氧化物的是Al(OH)3;
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式NH3,其水溶液显碱性(填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N):m(H)=7:1(相对原子质量:N一14 H-1)
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
(2)化学性质最不活泼的单质是Ar;
(3)C和O中,原子半径较大的是C;
(4)某原子结构示意图为
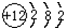 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;(5)硫有两种重要氧化物,分别为SO2和SO3(填化学式);
(6)H2S和HCl中,热稳定性较强的是HCl;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是NaOH;属于两性氢氧化物的是Al(OH)3;
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式NH3,其水溶液显碱性(填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N):m(H)=7:1(相对原子质量:N一14 H-1)
13.下列说法正确的是( )
| A. | 非金属元素组成的化合物中只可能含有共价键 | |
| B. | VIIA族元素气态氢化物的热稳定性从上到下依次减弱 | |
| C. | 第二周期元素原子的半径从左到右依次增大 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
20.数据分析能力是新课程对中学生提出的一项要求.表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见表:
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
14.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| B. | 铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L | |
| C. | 1 mol•L-1的NH4Cl溶液中的NH4+的数目小于NA | |
| D. | 由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
15.下列对实验操作及结论的描述正确的是( )
| A. |  用于分离I2和NH4Cl | |
| B. |  用于测定某稀盐酸的物质的量浓度 | |
| C. |  加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯 | |
| D. |  滴入浓硫酸后,KMnO4溶液褪色,说明浓硫酸起到了脱水剂和氧化剂的作用 |