题目内容
10.室温时,pH=a的氨水与PH=b的盐酸等体积混合,恰好完全反应,则氨水电离度可表示为10(a+b-12)%(用百分数来表示)分析 根据二者恰好反应可知n(NH3•H2O)=n(HCl),根据α=$\frac{{c}_{已电离}}{{c}_{总}}$×100%计算氨水的电离度.
解答 解:pH=b的盐酸中c(H+)=c(HCl)=10-bmol/L,
二者恰好反应可知c(NH3•H2O)=c(HCl)=10-bmol/L,
pH=a的氨水中n(OH-)=10a-14mol/L,即已电离的c(NH3•H2O)=10a-14mol/L,
所以该氨水的电离度为:$\frac{1{0}^{a-14}mol/L}{1{0}^{-b}mol/L}$×100%=10(a+b-12)%,
故答案为:10(a+b-12)%.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确电离度的概念为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.数据分析能力是新课程对中学生提出的一项要求.表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见表:
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
(1)第2次实验中产生沉淀质量是多少克?请将结果填在表格相应空格中.
(2)样品中KHCO3和Na2CO3的物质的量之比是2:3.
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05mol/L的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程).
1.下列关于物质的量的叙述中,错误的是( )
| A. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数 | |
| B. | 1molH2O中含有3mol原子 | |
| C. | 1molH2O中含有2 mol氢和1mol氧 | |
| D. | 0.012Kg12C中约含有6.02×1023个碳原子 |
15.下列对实验操作及结论的描述正确的是( )
| A. |  用于分离I2和NH4Cl | |
| B. |  用于测定某稀盐酸的物质的量浓度 | |
| C. | 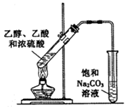 加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯 | |
| D. |  滴入浓硫酸后,KMnO4溶液褪色,说明浓硫酸起到了脱水剂和氧化剂的作用 |
19.下列制备单质的方法中,还需要有还原剂加入的是( )
| A. | 利用海水提取金属镁 | |
| B. | 海水提溴过程中富集溴元素 | |
| C. | 从海带灰浸取液 (含I-)中提取碘单质 | |
| D. | 利用氧化银制取金属银 |
20.N2+3H2$?_{高温高压}^{催化剂}$2NH3制造氮肥的重要反应.下列关于该反应的说法正确的是( )
| A. | 增加N2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | N2足量时,H2能100%转化为NH3 |
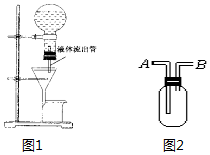 (1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.
(1)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图1所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通.