题目内容
某温度下,反应H2(g)+I2(g)?2HI(g);△H>0.在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
| A、恒温,压缩体积,平衡不移动,混合气体颜色加深 |
| B、恒压,充入HI(g),开始时正反应速率减小 |
| C、恒容,升高温度,正反应速率减小 |
| D、恒容,充入H2,I2(g)的体积分数降低 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:首先分析化学反应方程式的特征,反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,反应放热,升高温度,平衡向逆反应方向移动,据此解答.
解答:
解:A、反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,恒温,压缩体积,平衡不移动,但体积减小,浓度增大,所以颜色加深,故A正确;
B、恒压,充入HI(气),开始时反应物的浓度减小,则正反应速率减小,故B正确;
C、升高温度,正逆反应速率都增大,故C错误;
D、恒容,充入H2,平衡向正反应方向移动,I2的物质的量减小,所以正向移动程度小,再次达到平衡时H2(g)的体积分数增大,故D正确;
故选C.
B、恒压,充入HI(气),开始时反应物的浓度减小,则正反应速率减小,故B正确;
C、升高温度,正逆反应速率都增大,故C错误;
D、恒容,充入H2,平衡向正反应方向移动,I2的物质的量减小,所以正向移动程度小,再次达到平衡时H2(g)的体积分数增大,故D正确;
故选C.
点评:本题考查化学平衡的影响因素,题目难度中等,本题注意反应中气体化学计量数的关系,注意温度和压强对化学平衡的影响,易错点为B.

练习册系列答案
相关题目

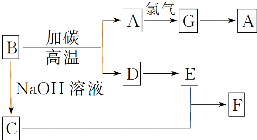 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
