题目内容
3.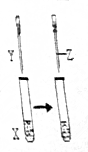 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯酚和氢氧化钠溶液反应生成可溶性的苯酚钠,苯酚钠和盐酸反应生成苯酚;
B.加入KCl固体,溶液颜色不变;
B.水和乙醇互溶;
D.亚硫酸钡被硝酸氧化生成硫酸钡.
解答 解:A.常温下,苯酚的溶解度较小,所以苯酚溶液浑浊,苯酚和氢氧化钠溶液反应生成可溶性的苯酚钠,所以溶液变澄清,向苯酚钠溶液中滴加稀盐酸,苯酚钠和稀盐酸反应生成苯酚,所以溶液又变浑浊,所以实验现象是:溶液先变澄清后变浑浊,故A正确;
B.氯化铁和硫氰化钾溶液反应生成硫氰化铁而使溶液呈血红色,加入KCl固体,不参加反应,溶液颜色不变,故B错误;
C.氯气和碘离子反应生成碘单质,但水和乙醇互溶,所以混合溶液不分层,故C错误;
D.亚硫酸钠和硝酸钡溶液反应生成难溶性的亚硫酸钡,向混合溶液中加入稀盐酸,亚硫酸钡被硝酸氧化生成难溶性的硫酸钡,所以没有气体生成,沉淀不溶解,故D错误;
故选A.
点评 本题考查了化学实验方案评价,明确实验原理是解本题关键,根据物质的性质结合物质间的反应来分析解答,易错选项是D,注意:中性条件下,硝酸根离子没有强氧化性,但酸性条件下,硝酸根离子具有强氧化性,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列说法正确的是( )
| A. | 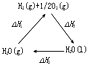 图中△H1=△H2+△H3 | |
| B. | 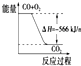 从图可看出CO2的能量高于CO+O2 | |
| C. |  从图可看出反应中加入催化剂可降低反应物能量 | |
| D. | 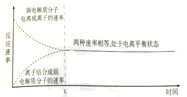 图中t0时间段后(不包含t0)电解质溶液中,弱电解质分子与离子都存在 |
11.在一定条件下,对于在密封容器中进行的反应:P(g)+Q(g)?R(g)+S(g),下列情况已经达到化学平衡状态的是( )
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |
18.恒容容器甲与恒压容器乙开始时的体积相同,均充有1molCH4和1molCO2的混合气体,发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ/mol,经一段时间均达到平衡(保持温度不变).有关平衡时的下列叙述正确的是( )
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
15.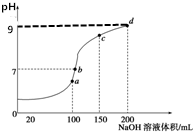 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )| A. | a点所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b点所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c点所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d点所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
7.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染.已知部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
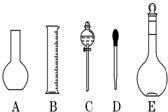 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: