题目内容
8.有机物A的 分子式为C4H10O2.符合下列条件的有机化合物A有(不考虑立体异构)( )①1molA与足量钠反应放出1mol氢气 ②1个碳原子上不能连接2个羟基.
| A. | 9种 | B. | 8种 | C. | 6种 | D. | 4种 |
分析 有机物A的分子式为C4H10O2,1molA与足量钠反应放出1mol氢气,说明该分子中含有两个醇羟基,且1个碳原子上不能连接2个羟基,二元取代物的同分异构体可以采用“定一议二”法解题.
解答 解:有机物A的分子式为C4H10O2,1molA与足量钠反应放出1mol氢气,说明该分子中含有两个醇羟基,且1个碳原子上不能连接2个羟基,C4H8(OH)2的同分异构体可以采取“定一议二”法确定:

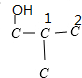 ,故C4H8(OH)2共有6种,故选C.
,故C4H8(OH)2共有6种,故选C.
点评 本题考查有机物同分异构体种类的确定,官能团已经确定,且不考虑立体异构,则只能是碳链异构,根据碳链异构分析解答即可,难度不大.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
18.缺铁性贫血是体内铁的储存不能满足正常红细胞生成的需要而发生的贫血,常用的补贴药物含硫酸亚铁、琥珀酸亚铁等,但长期放置会因氧化而部分变质,可检验药物是否变质的试剂是( )
| A. | 酸性高锰酸钾 | B. | KSCN溶液 | C. | 稀盐酸 | D. | 铁粉 |
19.现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示:据此,将甲和乙相互分离的最佳方法是( )
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 |
| 甲 | -68 | 115 | 0.93 | 易溶于水 |
| 乙 | -84 | 77 | 0.90 | 易溶于甲 |
| A. | 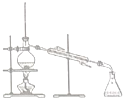 | B. | 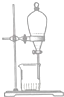 | C. | 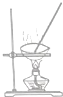 | D. |  |
16.对下列实验的描述正确的是( )
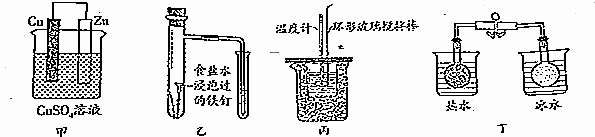

| A. | 图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性 | |
| B. | 图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图丙所示的实验:根据温度计读数的变化用浓硫酸和Na0H反应测定中和热 | |
| D. | 图丁所示的实验:根据两烧瓶中气体颜色的变化判断2N02(g)?N20(g)是吸热反应 |
3.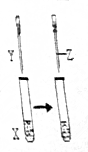 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
20.戊二醛(C5H802)消毒液是一种新型、高效、低毒的中强性消毒液,与其互为同分异构体的链状羧酸有(不含立体结构)( )
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
11.某金属冶炼厂的管道烟泥中含有某些金属,随机取样对烟泥进行分析.由下表中的数据可知,在烟泥中含有相当量的铜、锌以及能造成污染的硫.因此从效益和环保角度出发,应考虑把铜、锌回收利用,并对硫进行适当的处理.
【设计方案】
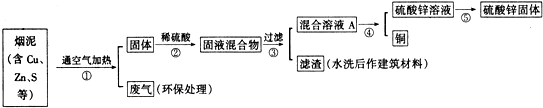
(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CuO+H2SO4=CuSO4+H2O.
(2)写出本方案中处理废气的方法(用化学方程式表示):2NaOH+SO2=Na2SO3+H2O.
(3)步骤⑤中所用的操作方法是:蒸发结晶(或蒸发、浓缩、结晶).
(4)在步骤④中,可选用试剂Zn从混合溶液A中得到铜.
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |

(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CuO+H2SO4=CuSO4+H2O.
(2)写出本方案中处理废气的方法(用化学方程式表示):2NaOH+SO2=Na2SO3+H2O.
(3)步骤⑤中所用的操作方法是:蒸发结晶(或蒸发、浓缩、结晶).
(4)在步骤④中,可选用试剂Zn从混合溶液A中得到铜.
12. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
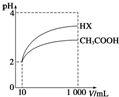
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.