题目内容
7.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染.已知部分弱酸的电离平衡常数如下表:| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
分析 A.酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性HCOOH>H2CO3>HCN>HCO3-,结合强酸制取弱酸判断;
B.HCN为弱酸,NaCN溶液水解溶液显显碱性;HCN的Ka=6.17×10-10,根据其水解方程式CN-+H2O?HCN+OH-,得水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{a}}$计算;
C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同.
解答 解:A.酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性HCOOH>H2CO3>HCN>HCO3-,结合强酸制取弱酸知,该反应方程式为CN-+H2O+CO2═HCN+HCO3-,故A错误;
B.HCN为弱酸,NaCN溶液水解溶液显显碱性;HCN的Ka=6.17×10-10,根据其水解方程式CN-+H2O?HCN+OH-,得水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{5.0×1{0}^{-10}}$=2×10-5=$\frac{c(O{H}^{-}).c(HCN)}{c(C{N}^{-})}$=$\frac{1{0}^{-5}×c(HCN)}{c(C{N}^{-})}$,所以c(CN-)<c(HCN),故C正确;
C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),等体积等pH的醋酸和HCN,HCN的物质的量多,中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比,所以HCN消耗的NaOH多,故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数多,故D正确;
故选A.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断计算能力,明确酸的电离平衡常数与酸性强弱关系是解本题关键,注意BD中公式及电荷的灵活变换,易错选项是BD.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案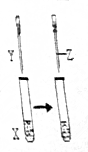 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1mol/LCH3COOH溶液,加水稀释过程中,所有离子浓度均减小 | |
| B. | 浓度均为0.1mol/L的NaF、CH3COONa溶液相比较,CH3COONa溶液pH大 | |
| C. | 反应HF+CH3COONa═NaF+CH3COOH可以发生 | |
| D. | NaF溶液中加少量NaOH固体,溶液中c(F-)变大 |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
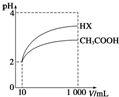
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
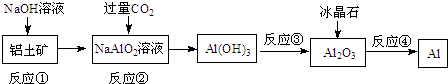
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
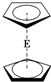 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为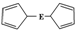 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: