题目内容
15.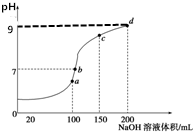 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )| A. | a点所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b点所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c点所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d点所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
分析 A.a点反应后溶质为硫酸铵,铵根离子部分水解,钠离子和硫酸根离子不水解,结合物料守恒判断;
B.b点为中性,说明氢氧化钠稍过量,则c(Na+)>c(SO42-)>c(NH4+)、c(OH-)=c(H+);
C.c点溶液的pH大于7,在c(OH-)>c(H+),结合电荷守恒判断;
D.d点为等浓度的硫酸钠和一水合氨,结合物料守恒和电荷守恒判断.
解答 解:A.a点加入100mL等浓度的氢氧化钠溶液,恰好反应生成硫酸铵,根据物料守恒可得:c(Na+)=c(SO42-)=c(NH4+)+c(NH3•H2O),则c(Na+)=c(SO42-)>c(NH4+),故A正确;
B.b点所示的溶液的pH=7,则:c(OH-)=c(H+),结合a点c(Na+)=c(SO42-)可知c(Na+)>c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.根据图象可知c点时的pH>7,则c(OH-)=c(H+),结合电荷守恒可知:c(Na+)+c(NH4+)>2c(SO42-),故C错误;
D.d点加入200mLNaOH溶液,反应后溶质为等浓度的硫酸钠和一水合氨,根据电荷守恒可知:c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),根据物料守恒可得:c(Na+)=2c(SO42-),二者结合可得:c(NH4+)+c(H+)=+c(OH-),即:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象各点发生反应及对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 中国化学家侯德榜研究了“侯氏联合制碱法”,为我国化工发展做出贡献 | |
| B. | 瑞典化学家舍勒发现软锰矿(含MnO2)与浓盐酸混合加热制得氯气 | |
| C. | 意大利物理甲阿伏伽德罗发现当光束通过胶体时可见一条光路 | |
| D. | 德国化学家哈伯在合成氨的研究中做出了巨大贡献 |
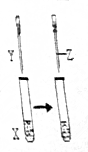 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
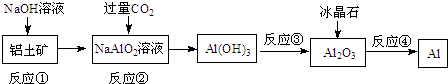
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: