题目内容
11.在一定条件下,对于在密封容器中进行的反应:P(g)+Q(g)?R(g)+S(g),下列情况已经达到化学平衡状态的是( )| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意该反应中气体的化学计量数之和前后相等的特点.
解答 解:A.反应平衡时各物质的物质的量浓度之比取决于起始物质的量浓度以及反应转化的程度,不能作为判断是否达到化学平衡的依据,故A错误;
B.反应为可逆反应,无论是否达到平衡状态,四种物质都共存,不能作为判断是否达到化学平衡的依据,故B错误;
C.各物质的浓度不变,化学反应达到平衡状态,故C正确;
D、反应中反应物和产物气体的系数和相等,所以反应过程中压强始终是一个定值,容器内的压强不再变的状态不一定是平衡状态,故D错误.
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,本题注意反应可逆的特点,注意正逆反应速率是否相等的判断.

练习册系列答案
相关题目
1.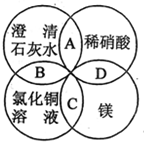 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
2. 短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
 短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )| A. | 原子半径的大小:W>X>M | |
| B. | 气态氢化物的稳定性:N>X>M | |
| C. | 对应的含氧酸的酸性强弱:W>X>N | |
| D. | W分别与N、X形成的化合物中的化学键均为极性键 |
19.现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示:据此,将甲和乙相互分离的最佳方法是( )
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 |
| 甲 | -68 | 115 | 0.93 | 易溶于水 |
| 乙 | -84 | 77 | 0.90 | 易溶于甲 |
| A. | 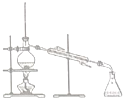 | B. | 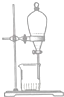 | C. | 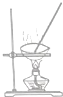 | D. | 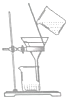 |
16.对下列实验的描述正确的是( )
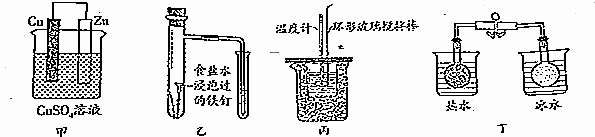

| A. | 图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性 | |
| B. | 图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图丙所示的实验:根据温度计读数的变化用浓硫酸和Na0H反应测定中和热 | |
| D. | 图丁所示的实验:根据两烧瓶中气体颜色的变化判断2N02(g)?N20(g)是吸热反应 |
3.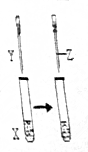 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
20.戊二醛(C5H802)消毒液是一种新型、高效、低毒的中强性消毒液,与其互为同分异构体的链状羧酸有(不含立体结构)( )
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
15.室温下K(HF)=7.2×10-4、K(CH3COOH)=1.75×10-5,下列说法不正确的是( )
| A. | 0.1mol/LCH3COOH溶液,加水稀释过程中,所有离子浓度均减小 | |
| B. | 浓度均为0.1mol/L的NaF、CH3COONa溶液相比较,CH3COONa溶液pH大 | |
| C. | 反应HF+CH3COONa═NaF+CH3COOH可以发生 | |
| D. | NaF溶液中加少量NaOH固体,溶液中c(F-)变大 |
 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.