题目内容
5.下列物质对应的电子式书写正确的是( )| A. | NaBr: | B. | MgCl2: | C. | KCl: | D. | Na2O2: |
分析 题中对应物质都为离子化合物,书写电子式时,金属阳离子的电子式为离子符号,阴离子应用[],以此解答该题.
解答 解:A.NaBr中钠离子电子式错误,应为 ,故A错误;
,故A错误;
B.氯离子缺少[],应为 ,故B错误;
,故B错误;
C.钾离子不能用[],而氯离子缺少[],应为 ,故C错误;
,故C错误;
D.为离子化合物,含有过氧根离子,电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了化学用语使用方法及规范性,为高考常见题型和高频考点,明确电子式书写方法及注意事项是解题关键,题目难度中等,注意物质的结构及所含化学键类型.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
16.某pH=2的无色透明溶液中,能大量共存的一组离子是( )
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
13.下列实验装置能达到实验目的是(夹持仪器未画出)( )
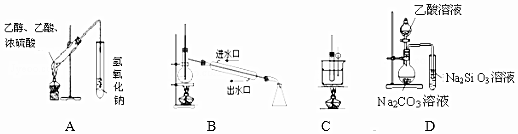

| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
17.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
14.下列说法不正确的是( )
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
18.已知下列热化学方程式:
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
H2(g)+O2(g)═H2O(g)△H=-241.8kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则氢气的燃烧热是( )
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
H2(g)+O2(g)═H2O(g)△H=-241.8kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则氢气的燃烧热是( )
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |