题目内容
16.某pH=2的无色透明溶液中,能大量共存的一组离子是( )| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
分析 pH=2的溶液显酸性,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe3+为黄色,与无色不符,故A错误;
B.酸性条件下AlO2-不能大量共存,故B错误;
C.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故C正确;
D.酸性条件下-、NO3-发生氧化还原反应而不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的离子反应判断,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
6.人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着.碱式磷酸钙的化学式中除钙离子外,还含有一个氢氧根离子和三个磷酸根离子,则其化学式正确的是( )
| A. | Ca2(PO4)3(OH) | B. | Ca5(PO4)3(OH) | C. | Ca4(PO4)3(OH) | D. | Ca3(PO4)3(OH) |
7.下表是部分城市某日空气质量日报:
(1)由上表可知,空气质量日报中涉及的污染物主要是SO2、NO2和可吸入颗粒物(PM10);四座城市中,最容易出现酸雨的城市是A.
(2)汽车尾气则是城市大气中氮氧化物的主要来源之一.治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,这些无毒气体是CO2、N2.
(3)SO2的排放是造成酸雨的主要因素.
①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的化学反应方程式2NaOH+SO2=Na2SO3+H2O.
②若将含二氧化硫的废气通入水中,在一段时间内连续不断测定溶液的pH值,发现pH值变小,这是由于空气中的氧气也参与了相关反应,表示该变化的化学方程式是2H2SO3+O2=2H2SO4.
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
(2)汽车尾气则是城市大气中氮氧化物的主要来源之一.治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,这些无毒气体是CO2、N2.
(3)SO2的排放是造成酸雨的主要因素.
①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的化学反应方程式2NaOH+SO2=Na2SO3+H2O.
②若将含二氧化硫的废气通入水中,在一段时间内连续不断测定溶液的pH值,发现pH值变小,这是由于空气中的氧气也参与了相关反应,表示该变化的化学方程式是2H2SO3+O2=2H2SO4.
11.下列物质与常用危险化学品的类别不对应的是( )
| A. | Na、K--遇湿易燃物品 | B. | TNT、NH4NO3--爆炸品 | ||
| C. | CH4、C2H5OH--易燃气体 | D. | 浓H2SO4、浓HNO3--腐蚀品 |
8.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙醇 | |
| B. | 将乙烷与溴水混合光照制溴乙烷 | |
| C. | 苯和硝基苯的混合物采用分液的方法分离 | |
| D. | 可用CCl4萃取碘水中的碘 |
5.下列物质对应的电子式书写正确的是( )
| A. | NaBr: | B. | MgCl2: | C. | KCl: | D. | Na2O2: |
9.CO是一种重要的含碳化合物,它与生产、生活息息相关.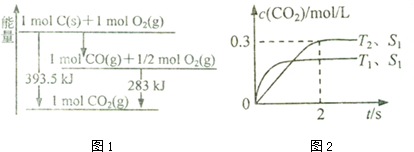
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)
