题目内容
17.下列关于电解质溶液的叙述正确的是( )| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
分析 A.电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商,根据电离常数计算溶液中的氢离子浓度;
B.向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,氨水分子浓度增大;
C.常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,根据电荷守恒、物料守恒判断;
D.同种类型的难溶物,溶度积越小越难溶,氢氧化钙、硫酸钙是不同类型的两种物质.
解答 解:A.常温下电离常数为Ka的酸HA是弱电解质,在溶液中部分电离,则电离方程式为HA?H++A-,c(H+)=$\sqrt{Ka×c(HA)}$,故A错误;
B.由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故B错误;
C.常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×$\frac{0.1mol/L}{2}$=0.1mol/L,溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),代入计算得到:2c(OH-)+c(CH3COO-)=c(CH3COOH)+2c(H+),即2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH),故C正确;
D.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,为硫酸钙微溶物,但氢氧化钙、硫酸钙是不同类型的两种物质,不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),故D错误;
故选C.
点评 本题考查了弱电解质的电离、盐类的水、离子浓度大小的比较等知识点,离子浓度大小的比较是学习的难点也是考试的热点,根据物料守恒和电荷守恒来进行分析即可,题目难度中等,注意掌握难溶物的沉淀转化溶度积比较的条件.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
(2)汽车尾气则是城市大气中氮氧化物的主要来源之一.治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,这些无毒气体是CO2、N2.
(3)SO2的排放是造成酸雨的主要因素.
①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的化学反应方程式2NaOH+SO2=Na2SO3+H2O.
②若将含二氧化硫的废气通入水中,在一段时间内连续不断测定溶液的pH值,发现pH值变小,这是由于空气中的氧气也参与了相关反应,表示该变化的化学方程式是2H2SO3+O2=2H2SO4.
| A. | 用酸性KMnO4溶液鉴别乙烯和乙醇 | |
| B. | 将乙烷与溴水混合光照制溴乙烷 | |
| C. | 苯和硝基苯的混合物采用分液的方法分离 | |
| D. | 可用CCl4萃取碘水中的碘 |
| A. | NaBr: | B. | MgCl2: | C. | KCl: | D. | Na2O2: |
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)重复出现 | |
| D. | 随着元素原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强重复出现 |
①将固体粉末X加入足量稀盐酸中,有红色不溶物出现,同时有气泡产生;
②取①中的溶液加适量的H2O2溶液,再滴入KSCN溶液,溶液显红色
则该固体粉末X可能为( )
| A. | Zn、CuO | B. | Fe、Al2O3 | C. | Fe、CuO | D. | Cu、FeO |

| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
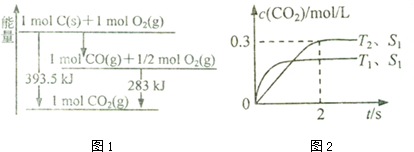
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
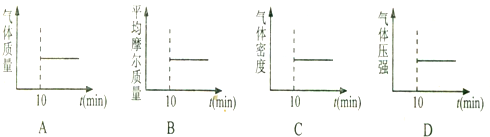
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| C. | 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较多的热量 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |