题目内容
14.下列说法不正确的是( )| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
分析 A.次氯酸钠溶液中次氯酸根离子水解生成次氯酸具有漂白性;
B.KSCN溶液过量,再继续加入KSCN溶液,溶液颜色加深说明平衡正向进行;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大;
D.测定等浓度的Na2CO3和Na2SO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性.
解答 解:A.浓度为0.1mol•L-1 NaClO溶液中次氯酸根离子水解生成次氯酸具有漂白性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH,故A错误;
B.将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,KSCN过量,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 ,故B正确;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,测定最高温度偏小,开始温度不变,则所测温度值偏小,故C正确;
D.测定等浓度的Na2CO3和Na2SO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性,亚硫酸不是最高价含氧酸,不能比较非金属性,故D错误;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等,注意元素化合物知识与实验的结合.

练习册系列答案
相关题目
5.下列物质对应的电子式书写正确的是( )
| A. | NaBr: | B. | MgCl2: | C. | KCl: | D. | Na2O2: |
2.某固体粉末X由两种物质组成,为确定该固体粉末的成分,某同学进行了以下实验:
①将固体粉末X加入足量稀盐酸中,有红色不溶物出现,同时有气泡产生;
②取①中的溶液加适量的H2O2溶液,再滴入KSCN溶液,溶液显红色
则该固体粉末X可能为( )
①将固体粉末X加入足量稀盐酸中,有红色不溶物出现,同时有气泡产生;
②取①中的溶液加适量的H2O2溶液,再滴入KSCN溶液,溶液显红色
则该固体粉末X可能为( )
| A. | Zn、CuO | B. | Fe、Al2O3 | C. | Fe、CuO | D. | Cu、FeO |
9.某固体混合物中可能含有:K+、Na+、Clˉ、CO32-、SO42-等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是( )


| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
9.CO是一种重要的含碳化合物,它与生产、生活息息相关.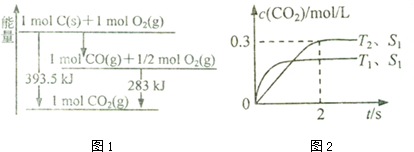
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

6.下列变化过程对应的现象正确的是( )
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |