题目内容
18.已知下列热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
H2(g)+O2(g)═H2O(g)△H=-241.8kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则氢气的燃烧热是( )
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |
分析 燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,所以氢生成液态水,而2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知,1mol氢气放出的热量,由此分析解答.
解答 解:燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,所以氢生成液态水,而2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知,1mol氢气的燃烧热是$\frac{571.6}{2}$=285.8 kJ•mol-1,所以氢气的燃烧热是285.8 kJ•mol-1,故选D.
点评 本题考查了燃烧热的概念,学生要了解燃烧热的定义,理解概念是解答的关键,题目较简单.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
5.下列物质对应的电子式书写正确的是( )
| A. | NaBr: | B. | MgCl2: | C. | KCl: | D. | Na2O2: |
9.CO是一种重要的含碳化合物,它与生产、生活息息相关.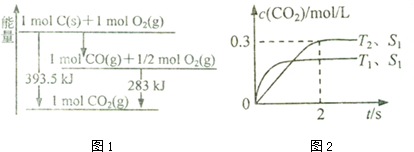
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

6.下列变化过程对应的现象正确的是( )
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学用语的表述正确的是( )
| A. | 乙醇的结构简式为CH3CH2OH,分子式为C2H5OH | |
| B. | 乙酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 中子数为16的磷原子可表示为${\;}_{15}^{31}$P | |
| D. | S2-结构示意图为 |
10.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| C. | 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较多的热量 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
8.下列反应的离子方程式正确的是( )
| A. | NaHCO3与足量Ca(OH)2的反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO${\;}_{{3}_{\;}^{\;}}^{2-}$+2H2O | |
| B. | 少量Na投入冷水中;Na+2H2O═Na++OH-+H2↑ | |
| C. | CuSO4与Ba(OH)2的反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | AlCl3溶液中加入足量氨水:Al3++4OH-═AlO2-+2H2O |