题目内容
(1)已知反应:2H2+O2=2H2O;△H=-484kJ?mol-1,请填写下列表格中空白处的总能量值,并注明消耗还是放出.有关键能:H-H:436kJ/mol;O-O:496kJ/mol;H-O:463kJ/mol
(2)化学反应中的能量变化,通常表现为 ,如果反应物具有的总能量高于生成物所具有的总能量,那么该反应是 反应;反之,该反应是 反应.如Ba(OH)2?8H2O跟NH4Cl的反应就是 反应.
(3)人体内葡萄糖氧化作用可以用以下热化学方程式表示:(相对原子质量C:12 H:1 O:16)C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2804.6kJ?mol-1.若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少 g.
| 拆开化学键 | 形成化学键 | 则上述反应中能量变化是多少(列出计算式)?是放热还是吸热? |
| 2mol H2中的化学键 | 4mol H-O键 | |
| 1mol O2中的化学键 |
(3)人体内葡萄糖氧化作用可以用以下热化学方程式表示:(相对原子质量C:12 H:1 O:16)C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2804.6kJ?mol-1.若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少
考点:化学能与热能的相互转化
专题:化学反应中的能量变化
分析:(1)旧键的断裂吸收能量,新键的生成释放能量,两个能量的差值即为反应的能量变化值,当旧键的断裂吸收能量大于新键的生成释放能量,则反应是吸热反应,反之是放热反应;
(2)化学反应都有新物质生成,同时,化学反应还伴随着能量变化,通常表现为反应过程中的放热或吸热,如果参加反应的反应物所具有的能量高于生成物所具有的能量,该化学反应将向环境中释放能量,反之吸收能量;
(3)根据热化学方程式的意义来计算.
(2)化学反应都有新物质生成,同时,化学反应还伴随着能量变化,通常表现为反应过程中的放热或吸热,如果参加反应的反应物所具有的能量高于生成物所具有的能量,该化学反应将向环境中释放能量,反之吸收能量;
(3)根据热化学方程式的意义来计算.
解答:
解:(1)拆开化学键的过程是吸收能量的过程,所以拆开2molH2和1molO2中的化学键吸收的能量为:436kJ/mol×2+496kJ/mol=1368kJ/mol,形成化学键的过程是释放能量的过程,则形成4molH-O键释放的能量为:463kJ/mol×4=1852 kJ/mol,旧键的断裂吸收能量小于新键的生成释放能量,则反应是放热反应,放出的能量为484kJ.
故答案为:放热484kJ.
(2)化学反应都随着能量变化,通常表现为热能,即反应过程中的放热或吸热,如果参加反应的反应物所具有的能量高于生成物所具有的能量,该化学反应将向环境中释放能量,反之吸收能量,氯化铵和氢氧化钡晶体的反应是吸热的反应,故答案为:热能;放热;吸热;吸热.
(3)根据热化学方程式C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2804.6kJ?mol-1的意义:1mol葡萄糖完全氧化放热2804.6kJ,1mol葡萄糖是180g,即180g葡萄糖完全氧化放热2804.6kJ,每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖的质量是
=806.4g,故答案为:806.4.
故答案为:放热484kJ.
(2)化学反应都随着能量变化,通常表现为热能,即反应过程中的放热或吸热,如果参加反应的反应物所具有的能量高于生成物所具有的能量,该化学反应将向环境中释放能量,反之吸收能量,氯化铵和氢氧化钡晶体的反应是吸热的反应,故答案为:热能;放热;吸热;吸热.
(3)根据热化学方程式C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2804.6kJ?mol-1的意义:1mol葡萄糖完全氧化放热2804.6kJ,1mol葡萄糖是180g,即180g葡萄糖完全氧化放热2804.6kJ,每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖的质量是
| 12558kJ×180g |
| 2804.6kJ |
点评:本题考查学生化学反应中的能量变化知识,注意旧键的断裂吸收能量,新键的生成释放能量,二者的大小决定反应的吸放热情况,难度不大.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )
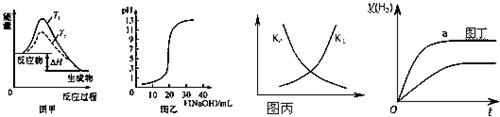

| A、图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B、图乙表示0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得到的滴定曲线 |
| C、图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
20mL 0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液.已知:Kaq=[Fe(OH)3]=4.0×10-38,Kaq=[Fe(OH)2]=8.0×10-16.( )
| A、沉淀中只有Fe(OH)3 |
| B、沉淀中有Fe(OH)3和Fe(OH)2 |
| C、滤液c(Fe3+)=4.0×10-8mol/L |
| D、向滤液中滴加FeCl2溶液,无沉淀产生 |
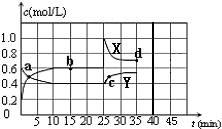 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答: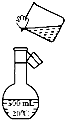 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题: