题目内容
20mL 0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液.已知:Kaq=[Fe(OH)3]=4.0×10-38,Kaq=[Fe(OH)2]=8.0×10-16.( )
| A、沉淀中只有Fe(OH)3 |
| B、沉淀中有Fe(OH)3和Fe(OH)2 |
| C、滤液c(Fe3+)=4.0×10-8mol/L |
| D、向滤液中滴加FeCl2溶液,无沉淀产生 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:AB.根据c(Fe2+)×c(OH-)2与Ksp=[Fe(OH)2]的关系分析;
C.根据Ksp=[Fe(OH)3]=c(Fe3+)×c(OH-)3计算;
D.向滤液中滴加FeCl2溶液,溶液的PH增大.
C.根据Ksp=[Fe(OH)3]=c(Fe3+)×c(OH-)3计算;
D.向滤液中滴加FeCl2溶液,溶液的PH增大.
解答:
解:AB.20mL 0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,则c(OH-)=10-10mol/L,Ksp[Fe(OH)2]=8.0×10-16=c(Fe2+)×c(OH-)2=c(Fe2+)×(10-10)2,解得c(Fe2+)=8×104mol/L,所以溶液中没有Fe(OH)2沉淀,Fe(OH)2在溶液中易被氧化为Fe(OH)3;所以溶液中生成的沉淀是Fe(OH)3沉淀,故A正确,B错误;
C.已知溶液的PH=4,则c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c(OH-)3=c(Fe3+)×(10-10)3,解得c(Fe3+)=4.0×10-8mol/L,所以滤液c(Fe3+)=4.0×10-8mol/L,故C正确;
D.向滤液中滴加FeCl2溶液,溶液的体积增大,氢氧根离子的浓度减小,所以没有沉淀生成,故D正确;
故选B.
C.已知溶液的PH=4,则c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c(OH-)3=c(Fe3+)×(10-10)3,解得c(Fe3+)=4.0×10-8mol/L,所以滤液c(Fe3+)=4.0×10-8mol/L,故C正确;
D.向滤液中滴加FeCl2溶液,溶液的体积增大,氢氧根离子的浓度减小,所以没有沉淀生成,故D正确;
故选B.
点评:本题考查了溶度积常数的计算,侧重于考查学生分析问题和解决问题的能力及计算能力,题目难度中等.

练习册系列答案
相关题目
对电解质的叙述正确的是( )
| A、溶于水后得到的溶液能导电的物质 |
| B、BaSO4、AgCl是难溶物,但它们是电解质 |
| C、盐酸、氨水、CO2都是电解质 |
| D、在水溶液中或熔融状态下能导电的化合物 |
把6.72L NO2气体,依次通过下列3个分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集到集气瓶中并得到200mL溶液,下列说法错误的是(气体体积均在标况下测定)( )
| A、最后所得溶液的物质的量浓度是0.33mol/L |
| B、通过装置①②后气体体积仍为6.72L |
| C、通过装置③后所得气体呈红棕色 |
| D、集气瓶中收集到0.025mol O2 |
原子序数为1-18号的元素中,下列叙述正确的是( )
| A、最外层只有1个电子的元素一定是金属元素 |
| B、最外层只有2个电子的元素一定是金属元素 |
| C、原子核外各层电子数相等的元素不一定是金属元素 |
| D、核电荷数为17的元素的原子在化学反应中容易得到1个电子 |
第三周期元素基态原子中未成对电子数最多可达( )
| A、2个 | B、3个 | C、4个 | D、5个 |
A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数 是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、原子半径:A<B<C<D |
| B、B元素在周期表中的位置为第二周期第 VIA族 |
| C、D元素最高价氧化物的水化物难溶于水 |
| D、C、D、A、B四种元素的最高化合价依次升高 |
已知反应A2(g)+2B2(g)?2AB2(g)△H>0,下列说法正确的是( )
| A、升高温度正反应速率加快,逆反应速率减慢 |
| B、0.1mol A2和0.2mol B2反应达到平衡时生成0.2mol AB2 |
| C、达平衡后,升高温度,B的转化率增大 |
| D、催化剂可同等程度地改变正、逆反应速率 |
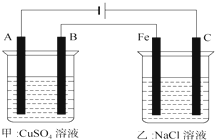 如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答: