题目内容
已知元素A、B、C、D、E的核电荷数依次增大,其中A、B、C同周期,化合物DC为离子化合物,D的二价阳离子与氖原子具有相同的电子层结构.A的单质为最硬的天然矿物.E的原子序数是D的两倍.
(1)A的单质的名称为 .
(2)B和C相比较,非金属性较强的是元素C.下列 (写编号)能够证明你的结论.
a.气态氢化物的稳定性 b.单质分子中的键能
c.两元素的电负性 d.单质的沸点
(3)B的外围电子排布式为 .E的正三价氯化物ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为1:2,3个氯离子位于外界.ECl3形成的配合物的化学式为 .
(4)D的单质可以在A的最高价氧化物中燃烧并生成单质A,写出该反应的化学方程式 .
(1)A的单质的名称为
(2)B和C相比较,非金属性较强的是元素C.下列
a.气态氢化物的稳定性 b.单质分子中的键能
c.两元素的电负性 d.单质的沸点
(3)B的外围电子排布式为
(4)D的单质可以在A的最高价氧化物中燃烧并生成单质A,写出该反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:元素A、B、C、D、E的核电荷数依次增大,D的二价阳离子与氖原子具有相同的电子层结构,则D是Mg元素;
A的单质为最硬的天然矿物,则A是C元素;
其中A、B、C同周期,化合物DC为离子化合物,则C是O元素;
B的原子序数大于A而小于C,所以B是N元素;
E的原子序数是D的两倍,则E是Cr元素,
再结合物质结构和性质解答.
A的单质为最硬的天然矿物,则A是C元素;
其中A、B、C同周期,化合物DC为离子化合物,则C是O元素;
B的原子序数大于A而小于C,所以B是N元素;
E的原子序数是D的两倍,则E是Cr元素,
再结合物质结构和性质解答.
解答:
解:元素A、B、C、D、E的核电荷数依次增大,D的二价阳离子与氖原子具有相同的电子层结构,则D是Mg元素;
A的单质为最硬的天然矿物,则A是C元素;
其中A、B、C同周期,化合物DC为离子化合物,则C是O元素;
B的原子序数大于A而小于C,所以B是N元素;
E的原子序数是D的两倍,则E是Cr元素,
(1)A单质名称是金刚石,故答案为:金刚石;
(2)B是N元素、C是O元素,元素的非金属性越强,其氢化物越稳定、其电负性越大、其最高价氧化物的水化物酸性越强,非金属性强弱与单质分子中的键能、单质的沸点无关,故选ac;
(3)B是N元素,其2s、2p电子为其外围电子,所以N元素的外围电子排布式为,Cr的正三价氯化物CrCl3能与N、O的氢化物形成六配位的配合物,且两种配体的物质的量之比为1:2,3个氯离子位于外界,则CrCl3形成的配合物的化学式为[Cr(NH3)2(H2O)4]Cl3 或[Cr(H2O)4(NH3)2]Cl3,
故答案为:2s22p3;[Cr(NH3)2(H2O)4]Cl3 或[Cr(H2O)4(NH3)2]Cl3;
(4)Mg在二氧化碳中燃烧生成氧化镁和C,反应方程式为2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C.
A的单质为最硬的天然矿物,则A是C元素;
其中A、B、C同周期,化合物DC为离子化合物,则C是O元素;
B的原子序数大于A而小于C,所以B是N元素;
E的原子序数是D的两倍,则E是Cr元素,
(1)A单质名称是金刚石,故答案为:金刚石;
(2)B是N元素、C是O元素,元素的非金属性越强,其氢化物越稳定、其电负性越大、其最高价氧化物的水化物酸性越强,非金属性强弱与单质分子中的键能、单质的沸点无关,故选ac;
(3)B是N元素,其2s、2p电子为其外围电子,所以N元素的外围电子排布式为,Cr的正三价氯化物CrCl3能与N、O的氢化物形成六配位的配合物,且两种配体的物质的量之比为1:2,3个氯离子位于外界,则CrCl3形成的配合物的化学式为[Cr(NH3)2(H2O)4]Cl3 或[Cr(H2O)4(NH3)2]Cl3,
故答案为:2s22p3;[Cr(NH3)2(H2O)4]Cl3 或[Cr(H2O)4(NH3)2]Cl3;
(4)Mg在二氧化碳中燃烧生成氧化镁和C,反应方程式为2Mg+CO2
| ||
| ||
点评:本题考查了元素位置结构性质的相互关系及应用,涉及氧化还原反应、配合物、元素非金属性强弱的判断等知识点,正确推断元素是解本题关键,再结合物质结构、元素周期律来解答,题目难度不大.

练习册系列答案
相关题目
第三周期元素基态原子中未成对电子数最多可达( )
| A、2个 | B、3个 | C、4个 | D、5个 |
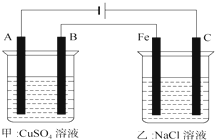 如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答: