题目内容
(1)写出下列反应的离子方程式
用稀硝酸清洗铁锈
氢氧化铜与稀硫酸反应
水垢(成分碳酸钙)溶解于醋酸溶液
单质Al溶于氢氧化钠溶液
(2)用双线桥标出下列反应中的电子转移的方向及数目
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(3)用单线桥标出下列反应中的电子转移的方向及数目
2FeCl3+2HI=2FeCl2+2HCl+I2.
用稀硝酸清洗铁锈
氢氧化铜与稀硫酸反应
水垢(成分碳酸钙)溶解于醋酸溶液
单质Al溶于氢氧化钠溶液
(2)用双线桥标出下列反应中的电子转移的方向及数目
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(3)用单线桥标出下列反应中的电子转移的方向及数目
2FeCl3+2HI=2FeCl2+2HCl+I2.
考点:离子方程式的书写,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题,离子反应专题
分析:(1)铁锈的主要成分为氧化铁,氧化铁与稀硝酸反应生成硝酸铁和水;
氢氧化铜为难溶物,离子方程式中需要保留化学式,氢氧化铜与稀硫酸反应生成硫酸铜和水;
碳酸钙为难溶物、醋酸为弱电解质,需要保留化学式,碳酸钙与醋酸反应生成醋酸钙、二氧化碳和水;
铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)铜为还原剂,硝酸为氧化剂,反应中铜失去3×2e-个电子,硝酸中氮原子导电2×3e-个电子,然后根据双线桥的表示方法进行解答;
(3)铁离子为在反应中得到2×e-个电子,碘离子失去了2×e-个电子,然后根据单线桥的表示方法进行解答.
氢氧化铜为难溶物,离子方程式中需要保留化学式,氢氧化铜与稀硫酸反应生成硫酸铜和水;
碳酸钙为难溶物、醋酸为弱电解质,需要保留化学式,碳酸钙与醋酸反应生成醋酸钙、二氧化碳和水;
铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)铜为还原剂,硝酸为氧化剂,反应中铜失去3×2e-个电子,硝酸中氮原子导电2×3e-个电子,然后根据双线桥的表示方法进行解答;
(3)铁离子为在反应中得到2×e-个电子,碘离子失去了2×e-个电子,然后根据单线桥的表示方法进行解答.
解答:
解:(1)用稀硝酸清洗铁锈,氧化铁与硝酸反应生成硝酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
氢氧化铜与稀硫酸反应,氢氧化铜需要保留化学式,反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O;
水垢(成分碳酸钙)溶解于醋酸溶液,碳酸钙和醋酸都需要保留化学式,反应的离子方程式为:CaCO3+2HAc=Ca2++2Ac-+CO2↑+H2O;
单质Al溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Cu(OH)2+2H+=Cu2++2H2O;CaCO3+2HAc=Ca2++2Ac-+CO2↑+H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,铜为还原剂,硝酸为氧化剂,铜在反应中总共失去6个电子,硝酸在反应中得到了总共得到6个电子,用双线桥法表示该氧化还原反应为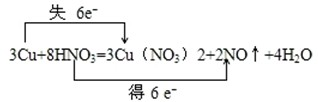 ,
,
故答案为: ;
;
(3)氯化铁中的铁离子做氧化剂,反应中铁离子得到2×e-个电子,碘化氢中碘为还原剂,反应中失去了2×e-个电子,用单线桥表示氧化还原反应为: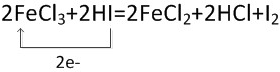 ,故答案为:
,故答案为: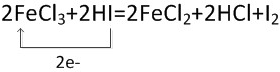 .
.
氢氧化铜与稀硫酸反应,氢氧化铜需要保留化学式,反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O;
水垢(成分碳酸钙)溶解于醋酸溶液,碳酸钙和醋酸都需要保留化学式,反应的离子方程式为:CaCO3+2HAc=Ca2++2Ac-+CO2↑+H2O;
单质Al溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Cu(OH)2+2H+=Cu2++2H2O;CaCO3+2HAc=Ca2++2Ac-+CO2↑+H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,铜为还原剂,硝酸为氧化剂,铜在反应中总共失去6个电子,硝酸在反应中得到了总共得到6个电子,用双线桥法表示该氧化还原反应为
 ,
,故答案为:
 ;
;(3)氯化铁中的铁离子做氧化剂,反应中铁离子得到2×e-个电子,碘化氢中碘为还原剂,反应中失去了2×e-个电子,用单线桥表示氧化还原反应为:
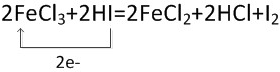 ,故答案为:
,故答案为: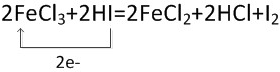 .
.
点评:本题考查了离子方程式的书写、用单线桥、双线桥分析氧化还原反应,题目难度中等,注意掌握离子方程式的书写原则,明确用单线桥、双线桥分析氧化还原反应的方法及区别.

练习册系列答案
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
在溶液中不能发生水解的离子是( )
| A、HS- |
| B、CO32- |
| C、Fe3+ |
| D、Br- |
对电解质的叙述正确的是( )
| A、溶于水后得到的溶液能导电的物质 |
| B、BaSO4、AgCl是难溶物,但它们是电解质 |
| C、盐酸、氨水、CO2都是电解质 |
| D、在水溶液中或熔融状态下能导电的化合物 |
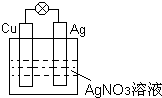 I.①如图所示,负极材料是
I.①如图所示,负极材料是