题目内容
 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:(1)请补充完整实验的简要步骤:
①计算;②称量NaOH固体
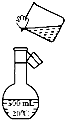
(2)如图是某同学转移溶液的示意图,图中有两处错误,请写出:
①
②
(3)下列操作使所配溶液浓度偏大的有
A.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
B.往容量瓶转移时有少量液体溅出
C.未洗涤溶解NaOH的烧杯
D.定容时仰视刻度线
E.容量瓶未干燥就用来配制溶液.
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据配制溶液的体积和浓度计算出需要氢氧化钠的质量;
溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;容量瓶规格不是1000mL;
(3)据物质的量浓度的表达式c=
进行误差分析.
溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;容量瓶规格不是1000mL;
(3)据物质的量浓度的表达式c=
| n |
| V |
解答:
解:(1)配制1000mL 0.40mol/L的NaOH溶液,需氢氧化钠的质量为m=1L×0.40mol?L-1×40g/mol=16g,
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,故答案为:16、定容;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;应该选用1000mL容量瓶;
故答案为:未用玻璃棒引流; 未采用1000 mL容量瓶;
(3)A、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后溶液体积偏小,配制的溶液浓度偏高;
B、往容量瓶转移溶液时,有少量液体溅出,导致溶质的物质的量偏小,配制的溶液的浓度偏低;
C、未洗涤烧杯、玻璃棒,会导致配制的溶液中溶质的物质的量减小,浓度偏低;
D、定容时仰视度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
E、容量瓶未干燥即用来配制溶液,对溶质的物质的量、溶液的体积都没有影响,所以不影响配制结果;
故答案为:A;BCD;E.
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,故答案为:16、定容;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;应该选用1000mL容量瓶;
故答案为:未用玻璃棒引流; 未采用1000 mL容量瓶;
(3)A、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后溶液体积偏小,配制的溶液浓度偏高;
B、往容量瓶转移溶液时,有少量液体溅出,导致溶质的物质的量偏小,配制的溶液的浓度偏低;
C、未洗涤烧杯、玻璃棒,会导致配制的溶液中溶质的物质的量减小,浓度偏低;
D、定容时仰视度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
E、容量瓶未干燥即用来配制溶液,对溶质的物质的量、溶液的体积都没有影响,所以不影响配制结果;
故答案为:A;BCD;E.
点评:本题考查一定物质的量浓度溶液的配制方法步骤、误差分析、注意事项等,难度不大,注意根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
相关题目
对电解质的叙述正确的是( )
| A、溶于水后得到的溶液能导电的物质 |
| B、BaSO4、AgCl是难溶物,但它们是电解质 |
| C、盐酸、氨水、CO2都是电解质 |
| D、在水溶液中或熔融状态下能导电的化合物 |
A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数 是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、原子半径:A<B<C<D |
| B、B元素在周期表中的位置为第二周期第 VIA族 |
| C、D元素最高价氧化物的水化物难溶于水 |
| D、C、D、A、B四种元素的最高化合价依次升高 |
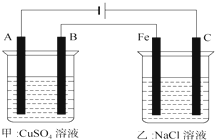 如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答: