题目内容
有某种有机物A(只含C、H、O元素) 3.1g在足量的氧气中充分燃烧,产物依次经过足量的无水硫酸铜和碱石灰,无水硫酸铜增重2.7g,碱石灰增重4.4g,相同条件下,测得该有机物的相对分子量为62,
试求:
(1)该有机物中C、H元素的个数之比
(2)该有机物的分子式为
(3)1mol该有机物与足量的金属钠反应,产生标况下22.4L的氢气,则该有机物的结构简式为(已知:两个羟基连在同一个碳原子上的结构不稳定)
试求:
(1)该有机物中C、H元素的个数之比
(2)该有机物的分子式为
(3)1mol该有机物与足量的金属钠反应,产生标况下22.4L的氢气,则该有机物的结构简式为(已知:两个羟基连在同一个碳原子上的结构不稳定)
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)该有机物的相对分子量为62,则3.1g该有机物的物质的量为0.05mol,无水硫酸铜增重的2.7g为水的质量,碱石灰增重的4.4g为二氧化碳的质量,据此可以计算出有机物A分子中碳氢元素个数之比,即实验式;
(2)计算出3.1g有机物中A中含有的C、H元素的质量,然后计算出氧元素的质量、物质的量从而达到该有机物的实验式,再结合相对分子量确定该有机物的分子式;
(3)根据该有机物的与钠反应生成氢气的物质的量关系确定含有羟基的数目,然后确定其结构简式.
(2)计算出3.1g有机物中A中含有的C、H元素的质量,然后计算出氧元素的质量、物质的量从而达到该有机物的实验式,再结合相对分子量确定该有机物的分子式;
(3)根据该有机物的与钠反应生成氢气的物质的量关系确定含有羟基的数目,然后确定其结构简式.
解答:
解:(1)无水硫酸铜增重2.7g,2.7g为水的质量,则n(H)=2n(H2O)=
×2=0.3mol,
碱石灰增重4.4g,4.4g为二氧化碳的质量,则n(C)=n(CO2)=
=0.1mol,
该有机物分子中C、H个数之比为:N(C):N(H)=n(C):n(H)=0.1mol:0.3mol=1:3,
答:该有机物中C、H元素的个数之比为1:3;
(2)3.1gA中含有碳元素的质量为:m(C)=12g/mol×0.1mol=1.2g,
含有氢元素质量为:m(H)=1g/mol×0.3mol=0.3g,
3.1gA中含有氧原子的物质的量为:
=0.1mol,
该有机物的相对分子量为62,则3.1g该有机物A的物质的量为:n(A)=
=0.05mol,
则1molA中含有C、H、O的物质的量分别为:
mol=2mol、
mol=6mol、
mol=2mol,
所以该有机物A的分子式为:C2H6O2,
答:该有机物的分子式为:C2H6O2;
(3)1mol该有机物与足量的金属钠反应,产生标况下22.4L的氢气,n(H2)=
=1mol,生成1mol氢气需要消耗2mol羟基,则该有机物中含有2个羟基,两个羟基连在同一个碳原子上的结构不稳定,所以有机物A为乙二醇,结构简式为:HOCH2-CH2OH,
答:该有机物的结构简式为:HOCH2-CH2OH.
| 2.7g |
| 18g/mol |
碱石灰增重4.4g,4.4g为二氧化碳的质量,则n(C)=n(CO2)=
| 4.4g |
| 44g/mol |
该有机物分子中C、H个数之比为:N(C):N(H)=n(C):n(H)=0.1mol:0.3mol=1:3,
答:该有机物中C、H元素的个数之比为1:3;
(2)3.1gA中含有碳元素的质量为:m(C)=12g/mol×0.1mol=1.2g,
含有氢元素质量为:m(H)=1g/mol×0.3mol=0.3g,
3.1gA中含有氧原子的物质的量为:
| 3.1g-1.2g-0.3g |
| 16g/mol |
该有机物的相对分子量为62,则3.1g该有机物A的物质的量为:n(A)=
| 3.1g |
| 62g/mol |
则1molA中含有C、H、O的物质的量分别为:
| 0.1 |
| 0.05 |
| 0.3 |
| 0.05 |
| 0.1 |
| 0.05 |
所以该有机物A的分子式为:C2H6O2,
答:该有机物的分子式为:C2H6O2;
(3)1mol该有机物与足量的金属钠反应,产生标况下22.4L的氢气,n(H2)=
| 22.4L |
| 22.4L/mol |
答:该有机物的结构简式为:HOCH2-CH2OH.
点评:本题考查有机物分子式、结构简式确定的计算,题目难度中等,试题侧重于学生分析能力和计算能力的考查,题目难度不大,注意根据生成水和二氧化碳的质量确定有机物的分子式,把握有机物的性质与结构的关系.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
已知A2+、B+、C-、D2-四种离子具有相同的电子排布结构,下列说法中正确的是( )
| A、这四种元素处于同一周期 |
| B、离子半径:A2+>B+>C->D2- |
| C、A与D的质子数相差4 |
| D、还原性:C-<D2- |
下列有关物质浓度关系的描述中,正确的是( )
| A、25℃时,向0.1mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| B、25℃时,NaB溶液的pH=8,c(Na+)+c(B-)=9.9×10-7mol?L-1 |
| C、0.1mol?L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| D、同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3) |
电子表所用电源常为微型银锌原电池,其电极为A2O和Zn,电解质溶液为KOH溶液,其电极反应分别为:Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=Ag+2OH-,下列叙述正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: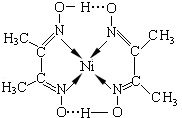
 Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则: