题目内容
利用下列反应:Fe+2Fe3+═3Fe2+制一个化学电池(给出若干导线,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出电极反应式.
(1) 是正极,正极的电极反应式: ;
(2) 是负极,负极的电极反应式: .
(3)若导线上转移电子0.2mol,则负极质量变化是 .
(1)
(2)
(3)若导线上转移电子0.2mol,则负极质量变化是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,正极可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液含有Fe3+.
解答:
解:已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,正极可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液含有Fe3+.
装置图为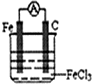 ,
,
(1)碳棒为正极,正极上Fe3+得电子生成Fe2+,其电极反应为:2Fe3++2e-═2Fe2+,故答案为:碳棒;2Fe3++2e-═2Fe2+;
(2)Fe为负极,失电子被氧化,其电极反应为:Fe-2e-═Fe2+,故答案为:铁;Fe-2e-═Fe2+;
(3)已知负极的反应为:Fe-2e-═Fe2+,每当导线上转移电子0.2mol,则负极上有0.1molFe溶解,所以负极质量变化是5.6g;故答案为:5.6g.
装置图为
 ,
,(1)碳棒为正极,正极上Fe3+得电子生成Fe2+,其电极反应为:2Fe3++2e-═2Fe2+,故答案为:碳棒;2Fe3++2e-═2Fe2+;
(2)Fe为负极,失电子被氧化,其电极反应为:Fe-2e-═Fe2+,故答案为:铁;Fe-2e-═Fe2+;
(3)已知负极的反应为:Fe-2e-═Fe2+,每当导线上转移电子0.2mol,则负极上有0.1molFe溶解,所以负极质量变化是5.6g;故答案为:5.6g.
点评:本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大,注意把握原电池的组成和原理,学习中注意基础知识的积累.

练习册系列答案
相关题目
从化学试剂商店买来的酒精试剂瓶上所贴的危险化学品标志是( )
A、 |
B、 |
C、 |
D、 |
下列各组有机化合物的相互关系,判断错误的是( )
A、 和 和 是同一物质 是同一物质 |
| B、CH2=CH2和CH2=CH-CH3互为同系物 |
C、 和 和 互为同系物 互为同系物 |
D、 和 和 互为同分异构体 互为同分异构体 |
现有(1)KCl、(2)MgSO4、(3)KOH、(4)CuCl2四种溶液,不用其他试剂,仅用观察法和相互反应就可以将其区别开来,则鉴别出来的先后顺序是( )
| A、(4)(3)(1)(2) |
| B、(3)(4)(2)(1) |
| C、(4)(2)(3)(1) |
| D、(4)(3)(2)(1) |








 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.