题目内容
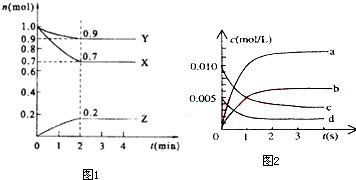
(Ⅰ)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图1所示.
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程为 ;
(3)当反应进行到第 min,该反应达到平衡,是因为 .
(Ⅱ).在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)图2中表示NO2的变化的曲线是 .
(2)用O2表示从0-2s内该反应的平均速率v=
(3)能说明该反应已经达到平衡状态的是 .
a、v(NO2)=2v(O2) b、容器内气体颜色保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程为
(3)当反应进行到第
(Ⅱ).在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0-2s内该反应的平均速率v=
(3)能说明该反应已经达到平衡状态的是
a、v(NO2)=2v(O2) b、容器内气体颜色保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变

考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(Ⅰ)(1)观察图象可知,转化的X的物质的量为1.0mol-0.7mol=0.3mol,起始物质的量为1.0mol,转化率为转化的物质的量与起始物质的量的百分比;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(3)从曲线的变化特点分析;
(Ⅱ)(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);
(2)根据v=
计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断.
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(3)从曲线的变化特点分析;
(Ⅱ)(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);
(2)根据v=
| △c |
| △t |
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断.
解答:
解:(Ⅰ)(1)观察图象可知,转化的X的物质的量为1.0mol-0.7mol=0.3mol,起始物质的量为1.0mol,转化率=
×100%=30%,故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为3X+Y 2Z,
2Z,
故答案为:3X+Y 2Z;
2Z;
(3)2min后,各物质的物质的量不再发生变化,说明反应达到平衡状态,故答案为:2;物质的量不再发生变化;
(Ⅱ)(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=
=0.0065mol/L,所以图中表示NO2变化的曲线是b,
故答案为:b;
(2)2s内用NO表示的平均反应速率v(NO)=
=
=3.0×10-3mol?L-1?s-1,速率之比等于化学计量数之比,
所以v(O2)=
v(NO)=
×3.0×10-3mol?L-1?s-1=1.5×10-3mol?L-1?s-1,
故答案为:1.5×10-3mol?L-1?s-1;
(3))a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc.
| 0.3mol |
| 1.0mol |
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为3X+Y
 2Z,
2Z,故答案为:3X+Y
 2Z;
2Z;(3)2min后,各物质的物质的量不再发生变化,说明反应达到平衡状态,故答案为:2;物质的量不再发生变化;
(Ⅱ)(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=
| 0.020mol-0.007mol |
| 2L |
故答案为:b;
(2)2s内用NO表示的平均反应速率v(NO)=
| △n(NO) |
| V?△t |
| 0.020mol-0.008mol |
| 2L?2s |
所以v(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:1.5×10-3mol?L-1?s-1;
(3))a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc.
点评:本题主要考查化学平衡图象、反应速率图象、反应速率计算、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
相关题目
α鸢尾酮香料的分子结构如图所示,下列说法中不正确的是( )


| A、α鸢尾酮可与某种酚互为同分异构体 |
| B、1 mol α鸢尾酮最多可与3 mol H2加成 |
| C、α鸢尾酮能发生银镜反应 |
D、α鸢尾酮经加氢→消去→加氢可转变为 |
以下实验能达到目的是( )
| A、向已经变质的FeCl2溶液中滴加KSCN溶液,溶液变红,则说明FeCl2已完全变质 |
| B、向某一无色气体中通入氧气,气体变红棕色,则证明有NO |
| C、可用PH试纸来测浓硫酸的PH值 |
| D、取某溶液,先后滴入氯化钡溶液和稀硝酸,产生白色沉淀,则该溶液中一定含有SO42- |
将标准状况下aL NH3溶解于1000g水中,得到氨水的物质的量浓度为b mol/L,则该氨水的密度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|









 某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.