题目内容
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:(1)铜是过渡元素.化合物中,铜常呈现+1价或+2价.
①铜原子的电子排布式
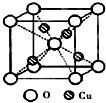
②右图为某铜矿晶体结构单元,该铜矿的化学式为
③已知,铜的第一电离能为746kJ?mol-1,第二电离能为1958kJ?mol-1.请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因
(2)Mg是第三周期元素,该周期部分元素氟化物的熔点见表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)CO的结构可表示为C≡O,N2的结构可表示为N≡N.如表是两者的键能数据(单位:kJ?mol-1)
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
(4)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(6)目前全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
①配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
②如右图所示配合物,其分子内存在的作用力有
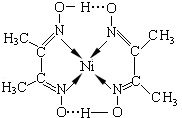
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键.
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用
专题:化学键与晶体结构
分析:(1)①根据能量最低原理和洪特规则书写电子排布式;②利用均摊法计算晶胞;③失去1个电子后,Cu+处于稳定状态,第二电离能较大;
(2)根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素分析表中氟化物熔点差异的原因;
(3)CO共价三键中含有2个π键;根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定;
(4)A和B为第三周期元素,A元素的第三电离能远远小于第四电离能,说明A元素最外层有3个电子,失去3个电子时达到稳定结构,所以A为Al元素;B元素的第二电离能远远小于第三电离能,则B元素最外层有2个电子,失去两个电子后达到稳定结构,所以B为Mg元素,结合结构和性质分析解答;
(5)根据钒离子和铬离子未成对电子判断;
(6)根据合物Ni(CO)4的性质、熔点、溶解性判断晶体类型;根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
(2)根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素分析表中氟化物熔点差异的原因;
(3)CO共价三键中含有2个π键;根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定;
(4)A和B为第三周期元素,A元素的第三电离能远远小于第四电离能,说明A元素最外层有3个电子,失去3个电子时达到稳定结构,所以A为Al元素;B元素的第二电离能远远小于第三电离能,则B元素最外层有2个电子,失去两个电子后达到稳定结构,所以B为Mg元素,结合结构和性质分析解答;
(5)根据钒离子和铬离子未成对电子判断;
(6)根据合物Ni(CO)4的性质、熔点、溶解性判断晶体类型;根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
解答:
解:(1)①Cu原子核外有29个电子,Cu的电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
②根据晶胞结构可知,O位于顶点和体心,共有:8×
+1=2个,Cu位于体心,共4个,n(Cu):n(O)=2:1,所以化学式为Cu2O,故答案为:Cu2O;
③Cu原子失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(2)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
(3)根据氮气分子结构知,一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个π键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:2;CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键所需的能量,CO比N2小很多,故CO更活泼;
(4)A和B为第三周期元素,A元素的第三电离能远远小于第四电离能,说明A元素最外层有3个电子,失去3个电子时达到稳定结构,所以A为Al元素;B元素的第二电离能远远小于第三电离能,则B元素最外层有2个电子,失去两个电子后达到稳定结构,所以B为Mg元素,A元素最外层有3个电子,常常容易失去3个电子而达到稳定结构,所以A元素通常显+3价,由于金属性Al<Mg,所以电负性A>B,故答案为:+3;>;
(5)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6;CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2,所以CrO2中的未成对电子数大于V2O5中未成对电子数,故选CrO2.故答案为:CrO2;
(6)配合物Ni(CO)4常温为液态,熔点低,易溶于CCl4、苯等有机溶剂,所以Ni(CO)4属于分子晶体; 根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故答案为:分子晶体;ACE.
根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故答案为:分子晶体;ACE.
②根据晶胞结构可知,O位于顶点和体心,共有:8×
| 1 |
| 8 |
③Cu原子失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(2)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
(3)根据氮气分子结构知,一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个π键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:2;CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键所需的能量,CO比N2小很多,故CO更活泼;
(4)A和B为第三周期元素,A元素的第三电离能远远小于第四电离能,说明A元素最外层有3个电子,失去3个电子时达到稳定结构,所以A为Al元素;B元素的第二电离能远远小于第三电离能,则B元素最外层有2个电子,失去两个电子后达到稳定结构,所以B为Mg元素,A元素最外层有3个电子,常常容易失去3个电子而达到稳定结构,所以A元素通常显+3价,由于金属性Al<Mg,所以电负性A>B,故答案为:+3;>;
(5)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6;CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2,所以CrO2中的未成对电子数大于V2O5中未成对电子数,故选CrO2.故答案为:CrO2;
(6)配合物Ni(CO)4常温为液态,熔点低,易溶于CCl4、苯等有机溶剂,所以Ni(CO)4属于分子晶体;
 根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故答案为:分子晶体;ACE.
根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故答案为:分子晶体;ACE.
点评:本题考查较为综合,涉及电子排布式书写、晶胞计算、化学键、电离能、电负性以及配合物知识,题目难度中等,本题中易错点为(6),注意配合物的分析和积累.

练习册系列答案
相关题目
下列物质不能通过单质化合制取的是( )
| A、SO2 |
| B、CuS |
| C、FeCl3 |
| D、Fe3O4 |
现有(1)KCl、(2)MgSO4、(3)KOH、(4)CuCl2四种溶液,不用其他试剂,仅用观察法和相互反应就可以将其区别开来,则鉴别出来的先后顺序是( )
| A、(4)(3)(1)(2) |
| B、(3)(4)(2)(1) |
| C、(4)(2)(3)(1) |
| D、(4)(3)(2)(1) |
0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )
| A、CH4 |
| B、C2H4 |
| C、C3H6 |
| D、C6H6 |

 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.