题目内容
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.(1)Mg和Al的总质量为
(2)硫酸的物质的量浓度为
(3)NaOH溶液的物质的量浓度为
考点:有关混合物反应的计算
专题:计算题
分析:结合图可知,0~20mL发生酸碱中和,20~200mL发生离子与碱生成沉淀的反应,200~240mL发生氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,最后剩余的沉淀为氢氧化镁;加入200mLNaOH溶液时生成沉淀最多,溶液中的溶质为硫酸钠,
(1)根据图象判断氢氧化铝、氢氧化镁的物质的量,再根据质量守恒定律计算出混合金属的质量;
(2)根据溶解氢氧化铝消耗的氢氧化钠的物质的量及氢氧化钠溶液体积计算出氢氧化钠溶液浓度,再根据200mL时溶质为硫酸钠计算出硫酸的浓度物质的量,然后根据c=
计算出硫酸的浓度;
(3)根据(2)的计算可知氢氧化钠溶液的浓度.
(1)根据图象判断氢氧化铝、氢氧化镁的物质的量,再根据质量守恒定律计算出混合金属的质量;
(2)根据溶解氢氧化铝消耗的氢氧化钠的物质的量及氢氧化钠溶液体积计算出氢氧化钠溶液浓度,再根据200mL时溶质为硫酸钠计算出硫酸的浓度物质的量,然后根据c=
| n |
| V |
(3)根据(2)的计算可知氢氧化钠溶液的浓度.
解答:
解:根据图可知,0~20mL发生酸碱中和,20~200mL发生离子与碱生成沉淀的反应,200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,200mL时生成沉淀最多,溶液中的溶质为硫酸钠,
(1)由图象可知,氢氧化镁的物质的量为0.15mol,则n(Mg)=n[Mg(OH)2]=0.15mol,溶解的氢氧化铝的物质的量为:0.35mol-0.15mol=0.2mol,根据铝原子守恒可得:n(Al)=0.2mol,则Mg和Al的总质量为:0.15mol×24g/mol+0.2mol×27g/mol=9g,
故答案为:9;
(2)由200~240mL发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,消耗氢氧化钠的物质的量为0.2mol,则c(NaOH)=
=5mol/L,200mL时生成沉淀最多,溶液中的溶质为硫酸钠,则c(H2SO4)=
=1mol/L,
故答案为:1mol/L;
(3)在加入240mLNaOH溶液时,Al(OH)3恰好全部转化为NaAlO2,由B的计算可知氢氧化钠溶液的浓度为5mol?L-1,
故答案为:5mol/L.
(1)由图象可知,氢氧化镁的物质的量为0.15mol,则n(Mg)=n[Mg(OH)2]=0.15mol,溶解的氢氧化铝的物质的量为:0.35mol-0.15mol=0.2mol,根据铝原子守恒可得:n(Al)=0.2mol,则Mg和Al的总质量为:0.15mol×24g/mol+0.2mol×27g/mol=9g,
故答案为:9;
(2)由200~240mL发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,消耗氢氧化钠的物质的量为0.2mol,则c(NaOH)=
| 0.2mol |
| 0.04L |
5mol/L×0.2L×
| ||
| 0.5L |
故答案为:1mol/L;
(3)在加入240mLNaOH溶液时,Al(OH)3恰好全部转化为NaAlO2,由B的计算可知氢氧化钠溶液的浓度为5mol?L-1,
故答案为:5mol/L.
点评:本题考查混合物反应的计算,题目难度中等,明确图象中曲线变化及其发生的化学反应为解答的关键,注意氢氧化铝能溶解在NaOH溶液中,侧重分析及计算能力的考查.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
下列四组实验中,操作正确且能达到预期目的是( )
A、 配制稀硫酸 |
B、 固体NaHCO3分解 固体NaHCO3分解 |
C、 制备Fe(OH)2沉淀 |
D、 收集NH3 |
在密闭容器中充入CO2、CO、H2、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加m g;则CO2:CO:H2:CH4的体积比为( )
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
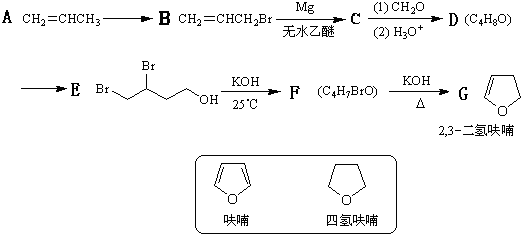


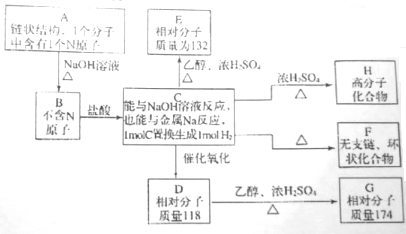
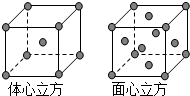 利用有关知识回答下列问题:
利用有关知识回答下列问题: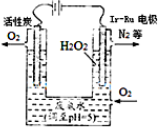 最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图
最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图