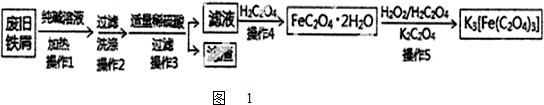
题目内容
在密闭容器中充入CO2、CO、H2、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加m g;则CO2:CO:H2:CH4的体积比为( )
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
考点:有关混合物反应的计算
专题:计算题
分析:根据2CO2+2Na2O2═2Na2CO3+O2可知,固体增重为与CO2等物质的量的CO的质量,根据2Na2O2+2H2O=4NaOH+O2可知,固体增重为与H2O等物质的量的H2的质量;在密闭容器中充入CO2、CO、H2、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则系列反应后CO2、CO、H2、CH4混合气体中所有元素均被吸收,故原混合物中CO2与CH4相对于CO、H2混合,据此进行分析.
解答:
解:根据2CO2+2Na2O2═2Na2CO3+O2可知:固体增重为与CO2等物质的量的CO的质量,
根据2Na2O2+2H2O=4NaOH+O2可知:固体增重为与H2O等物质的量的H2的质量,
在密闭容器中充入CO2、CO、H2、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则完全反应后CO2、CO、H2、CH4混合气体中所有元素均被吸收,
故原混合物中CO2与CH4相对于CO、H2混合,
所以只要满足CO2与CH4的体积之比为1:1即可,
故选C.
根据2Na2O2+2H2O=4NaOH+O2可知:固体增重为与H2O等物质的量的H2的质量,
在密闭容器中充入CO2、CO、H2、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则完全反应后CO2、CO、H2、CH4混合气体中所有元素均被吸收,
故原混合物中CO2与CH4相对于CO、H2混合,
所以只要满足CO2与CH4的体积之比为1:1即可,
故选C.
点评:本题考查混合物反应计算,题目难度中等,注意利用方程式判断固体质量增重情况,试题侧重考查学生分析能力,注意掌握常见反应原理,能够掌握书写反应方程式并得出质量变化特点为解答关键.

练习册系列答案
相关题目
进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是( )
| A、酸式滴定管 | B、碱式滴定管 |
| C、锥形瓶 | D、移液管 |
 如图所示是一套实验室制气装置,用于发生、干燥和收集气体,下列各组反应中能利用这套装置进行实验的是( )
如图所示是一套实验室制气装置,用于发生、干燥和收集气体,下列各组反应中能利用这套装置进行实验的是( )| A、碳酸钙和稀硫酸 |
| B、二氧化碳和浓盐酸 |
| C、铁和稀盐酸 |
| D、过氧化钠和水 |
下列实验可实现鉴别目的是( )
| A、用BaCl2溶液鉴别SO3(g)和SO2 |
| B、用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
| C、用CO2鉴别NaAlO2溶液和Na2SiO3溶液 |
| D、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
水溶液X中只可能溶有K+、Ca2+、AlO2-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶有进行了如下实验下列判断正确的是( )


| A、气体甲一定是纯净物 |
| B、沉淀甲是硅酸和硅酸钙的混合物 |
| C、K+、AlO2-、SiO32-、和CO32-一定存在于溶液X中 |
| D、SO42-一定不存在于溶液X中 |
有关物质用途的说法正确的是( )
| A、二氧化硅可用作半导体材料 |
| B、明矾可用于水的杀菌消毒 |
| C、碳酸氢钠可用于治疗胃酸过多 |
| D、硅可用于制造光导纤维 |
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.