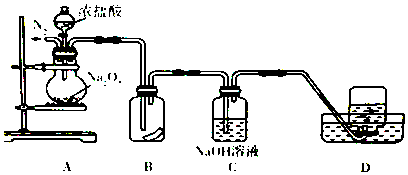
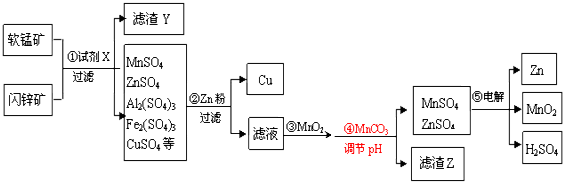
题目内容
6.如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )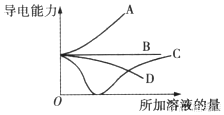
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
分析 A.稀盐酸和NaOH溶液混合时,溶液中离子浓度减小,溶液导电性降低;
B.醋酸是弱电解质,醋酸中加入KOH溶液生成强电解质醋酸钾,溶液中离子浓度增大,溶液导电性增强;
C.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,当二者完全反应时溶液中离子浓度最小,导电性最弱,继续加入稀硫酸,溶液中离子浓度增大,溶液导电性增强;
D.氢氧化铜是弱电解质,溶液中离子浓度较小,加入稀硝酸后生成强电解质硝酸铜,离子浓度增大,溶液导电性增强.
解答 解:A.稀盐酸和NaOH溶液混合时,溶液中离子浓度减小,溶液导电性降低,应该用D表示,故A错误;
B.醋酸是弱电解质,醋酸中加入KOH溶液生成强电解质醋酸钾,溶液中离子浓度增大,溶液导电性增强,应该用A表示,故B错误;
C.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,当二者完全反应时溶液中离子浓度最小,导电性最弱,继续加入稀硫酸,溶液中离子浓度增大,溶液导电性增强,应该用C表示,故C正确;
D.氢氧化铜是弱电解质,溶液中离子浓度较小,加入稀硝酸后生成强电解质硝酸铜,离子浓度增大,溶液导电性增强,应该用A表示,故D错误;
故选C.
点评 本题考查电解质溶液导电性及离子反应,为高频考点,明确溶液导电性强弱影响因素及离子反应实质是解本题关键,注意:电解质溶液导电性强弱与离子浓度成正比,与电解质强弱无关,题目难度不大.

练习册系列答案
相关题目
16.下列叙述正确的是( )
| A. | 电泳现象可说明胶体带电荷 | |
| B. | 胶体粒子很小,可以透过半透膜 | |
| C. | 直径在1-100nm之间的粒子称为胶体 | |
| D. | 是否具有丁达尔效应是溶液与胶体的本质区别 |
17.下列实验方案中,不可行的是( )
| A. | 用饱和食盐水除去Cl2中的HCl气体 | |
| B. | 用饱和碳酸氢钠溶液除去CO2中HCl气体 | |
| C. | 用Mg(OH)2除去MgCl2溶液中的少量FeCl3 | |
| D. | 用BaCl2溶液除去KNO3溶液中少量K2SO4 |
14.下列有关物质用途的说法中错误的是( )
| A. | 氯气可用于自来水的消毒 | |
| B. | 四氧化三铁常用作红色油漆和涂料 | |
| C. | 明矾可用于净水 | |
| D. | 过氧化钠用于呼吸面具和潜水艇里氧气的来源 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO42- | |
| B. | 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- | |
| C. | 使酚酞变红的溶液中:Na+、Cu2+、HCO3-、NO3- | |
| D. | 无色溶液中:K+、Ca2+、Cl-、NO3- |