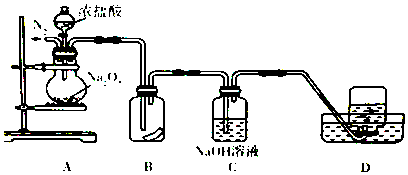
题目内容
12.下列实验操作或所记录的数据合理的是( )| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
分析 A.NaOH能和玻璃中二氧化硅反应生成黏性的硅酸钠;
B.氯水中次氯酸有漂白性;
C.溴易挥发,可水封保存,注意不能用橡胶塞;
D.硫酸亚铁易水解且易被空气氧化,配制硫酸亚铁溶液时要防止硫酸亚铁水解和被氧化.
解答 解:A.NaOH能和玻璃中二氧化硅反应生成黏性的硅酸钠,导致玻璃塞不易被打开,应该用橡胶塞,故A错误;
B.氯水中次氯酸有漂白性,所以不用pH试纸测定氯水pH值,应该用pH计,故B错误;
C.溴易挥发,可水封保存,注意不能用橡胶塞,应保存在磨口玻璃塞棕色细口试剂瓶中,故C正确;
D.硫酸亚铁易水解且易被空气氧化,配制硫酸亚铁溶液时要防止硫酸亚铁水解和被氧化,应该将硫酸亚铁溶于硫酸溶液中然后加水稀释,并在溶液中加入一定量的铁粉,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、pH值测定、药品储存等知识点,侧重考查学生分析判断能力,明确元素化合物性质、实验操作规范性是解本题关键,易错选项是BD.

练习册系列答案
相关题目
2. 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.
Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式
(写出最后结果)△H=-20.9(T2-T1)KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
Ⅱ.氧化还原滴定实验与中和滴定类似.为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为溶液由无色变为紫色.
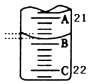
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是CD
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C=$\frac{60C}{V}$mol/L.
 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式
(写出最后结果)△H=-20.9(T2-T1)KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
Ⅱ.氧化还原滴定实验与中和滴定类似.为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为溶液由无色变为紫色.
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C=$\frac{60C}{V}$mol/L.
20.下列不能用勒夏特列原理解释的是( )
①盛满二氧化氮的烧瓶浸入热水中颜色变深 ②新制的氯水在光照条件下颜色变浅
③在H2、I2和HI组成的平衡体系中,加压,混合气体颜色变深 ④可用浓氨水和氢氧化钠固体快速制取氨气
⑤高锰酸钾溶液加水稀释后颜色变浅 ⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应 ⑧收集氯气用排饱和食盐水的方法.
①盛满二氧化氮的烧瓶浸入热水中颜色变深 ②新制的氯水在光照条件下颜色变浅
③在H2、I2和HI组成的平衡体系中,加压,混合气体颜色变深 ④可用浓氨水和氢氧化钠固体快速制取氨气
⑤高锰酸钾溶液加水稀释后颜色变浅 ⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应 ⑧收集氯气用排饱和食盐水的方法.
| A. | ②③⑤⑥ | B. | ③⑤⑥⑧ | C. | ③⑤⑥⑦ | D. | ④⑥⑦⑧ |
7.已知一定温度压强下,N2(g)+3H2(g)?2NH3(g),△H=-92kJ/mol,在同温下向某定容密闭容器甲中通入1.0molN2和3.0molH2,反应完成时放出热量Q1kJ,向另一体积相同的定容密闭容器乙中通入1.5molN2和3.0molH2,相同条件下反应完成时放出热量为Q2kJ,则下列关系正确的是( )
| A. | 2Q2=Q1=92.4 | B. | Q2<Q1<92.4 | C. | Q1=Q2=92.4 | D. | Q1<Q2<92.4 |
17.下列实验方案中,不可行的是( )
| A. | 用饱和食盐水除去Cl2中的HCl气体 | |
| B. | 用饱和碳酸氢钠溶液除去CO2中HCl气体 | |
| C. | 用Mg(OH)2除去MgCl2溶液中的少量FeCl3 | |
| D. | 用BaCl2溶液除去KNO3溶液中少量K2SO4 |
4.T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g)+2B(g)?C(g)
反应过程中测定的部分数据见表:下列说法正确的是( )
反应过程中测定的部分数据见表:下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10min内反应的平均速率为v(C)=0.050mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60molB气体,到达平衡时,n(C)<0.25mol | |
| C. | 若密闭容器体积不变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
15.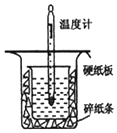 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌器,
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所求中和热相等(填“相等”“不相等”)
(3)结合实验数据填空:
①由表中数据可知反应前后溶液的平均温度差,即t2-t1的均值为:3.5℃.
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-58.52 kJ/mol.
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | t2-t1均值 | ||
| H2SO4 | NaOH | 均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29,6 | |
| 2 | 29.0 | 29.4 | 29,2 | 32.9 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所求中和热相等(填“相等”“不相等”)
(3)结合实验数据填空:
①由表中数据可知反应前后溶液的平均温度差,即t2-t1的均值为:3.5℃.
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-58.52 kJ/mol.