题目内容
4.下列为周期表的一部分,据此回答下列有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
分析 (1)由元素在周期表中位置,可知①为N、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱(稀有气体性质稳定);
(3)最高价氧化物对应的水化物中,酸性最强的是高氯酸;钠的金属性最强,氢氧化钠的碱性最强;氢氧化铝是两性氢氧化物.
解答 解:(1)由元素在周期表中位置,可知①为N、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar,
故答案为:N;Mg;Si;S;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱(稀有气体性质稳定),故上述元素金属性最强的为Na,非金属性最强的为F,
故答案为:Na;F;
(3)最高价氧化物对应的水化物中,酸性最强的是HClO4;钠的金属性最强,NaOH的碱性最强;Al(OH)3能与强酸、强碱反应生成盐与水,具有两性,
故答案为:HClO4;NaOH;Al(OH)3.
点评 本题考查元素周期表与元素周期律,需要学生熟练识记短周期元素,结合元素周期律知识进行解答,是对学生基础知识的巩固.

练习册系列答案
相关题目
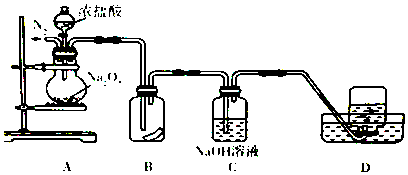
15.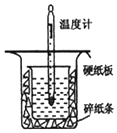 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌器,
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所求中和热相等(填“相等”“不相等”)
(3)结合实验数据填空:
①由表中数据可知反应前后溶液的平均温度差,即t2-t1的均值为:3.5℃.
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-58.52 kJ/mol.
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | t2-t1均值 | ||
| H2SO4 | NaOH | 均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29,6 | |
| 2 | 29.0 | 29.4 | 29,2 | 32.9 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所求中和热相等(填“相等”“不相等”)
(3)结合实验数据填空:
①由表中数据可知反应前后溶液的平均温度差,即t2-t1的均值为:3.5℃.
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-58.52 kJ/mol.
12.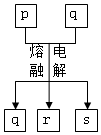 短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )| A. | 原子半径:Y>Z>W>X | |
| B. | q属于离子化合物 | |
| C. | p能与盐酸反应,但不能与氢氧化钠溶液反应 | |
| D. | 一定条件下,r与s能发生化合反应生成p |
19.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 水和四氯化碳 | C. | 汽油和植物油 | D. | 四氯化碳和苯 |
16.以共用电子对形成分子的化合物叫做共价化合物.下列物质属于共价化合物的是( )
| A. | H2 | B. | CO2 | C. | CaCl2 | D. | NaOH |