题目内容
19.下列说法正确的是( )| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |
分析 A.只含共价键的化合物是共价化合物;
B.含有离子键的化合物是离子化合物,离子化合物可能含有共价键;
C.金属性越强,金属键越弱;
D.双原子分子中共价键强弱是决定化学性质,而分子间作用力的强弱是决定物理性质.
解答 解:A.只含共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故A正确;
B.含有离子键的化合物是离子化合物,离子化合物可能含有共价键,如过氧化钠中既含离子键又含共价,故B错误;
C.金属性强的元素原子核对外层电子吸引力弱,外层电子更活跃,容易脱离原子,从而发生化学反应;金属键就是金属离子和自由电子的相互作用,故C错误;
D.双原子分子中共价键强弱是决定化学性质,而分子间作用力的强弱是决定物理性质,所以沸点高低是分子间作用力的大小决定的,故D错误;
故选A.
点评 本题考查了化合物类型和化学键类型的关系,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
14.对于可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述不能说明该反应已达到平衡状态的是( )
| A. | 化学反应速率:4v正(O2)=5v逆(NO) | |
| B. | NH3、O2、NO、H2O的分子个数比是4:5:4:6 | |
| C. | 单位时间内生成4 mol NO的同时消耗6 mol H2O | |
| D. | 反应混合物中NH3的体积分数不再改变 |
10.目前人们对环境保护、新能源开发很重视.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,如图1图象正确的是乙(填代号).
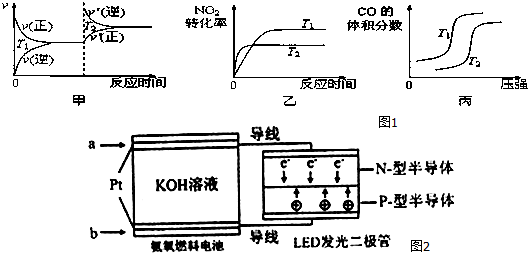
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO2)=0.015mol•L-1•min-1;计算该反应的平衡常数K=0.56.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入图2中a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6mol.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,如图1图象正确的是乙(填代号).

(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入图2中a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6mol.
8.如图为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为① ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为①
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O . 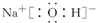 .
. .
.