题目内容
14.对于可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述不能说明该反应已达到平衡状态的是( )| A. | 化学反应速率:4v正(O2)=5v逆(NO) | |
| B. | NH3、O2、NO、H2O的分子个数比是4:5:4:6 | |
| C. | 单位时间内生成4 mol NO的同时消耗6 mol H2O | |
| D. | 反应混合物中NH3的体积分数不再改变 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.化学反应速率:4v正(O2)=5v逆(NO)=4v逆(O2),正逆反应速率相等,反应达到平衡状态,故A不选;
B.NH3、O2、NO、H2O的分子个数比是4:5:4:6,反应不一定达到平衡状态,与反应初始浓度及转化率有关,故B选;
C.单位时间内生成4 mol NO的同时消耗6 mol H2O,同时消耗4molNO,正逆反应速率相等,反应达到平衡状态,故C不选;
D.反应混合物中NH3的体积分数不再改变,正逆反应速率相等,反应达到平衡状态,故D不选;
故选B.
点评 本题考查化学平衡状态判断,为高频考点,侧重考查学生分析判断能力,如果用化学反应速率判断平衡状态时“反应方向必须相反”,注意化学平衡状态判断选取依据,易错选项是B.

练习册系列答案
相关题目
2.类推法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否.根据你所掌握的知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
9.下列说法正确的是( )
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
19.下列说法正确的是( )
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |
5. 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H
②CO(g)+2H2(g)?CH3OH(g)△H△
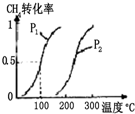
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率增大(填“增大”、“减小”或“不变”).
(2)反应①的△H>0(填“<”“=”或“>”);
100℃时的平衡常数值K=1.35×10-3.
(3)在压强为0.1Mpa条件下,将a molCO与3a molH2的混合气体在催化剂作用下进行反应②
再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
300°C时,其他条件不变,将容器的容积压缩到原来的$\frac{1}{2}$,对平衡体系产生的影响是(填
字母)CD
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△△H2=-556.0kJ•mol-1
③H2O(g)═H2O(l)△△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池
反应为:2CH3OH+3O2+4OH-?2CO32-+6H2O,放电时负极的电极反应方程为:CH3OH-6e-+8OH-=CO32-+6H2O.
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H
②CO(g)+2H2(g)?CH3OH(g)△H△
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率增大(填“增大”、“减小”或“不变”).
(2)反应①的△H>0(填“<”“=”或“>”);
100℃时的平衡常数值K=1.35×10-3.
(3)在压强为0.1Mpa条件下,将a molCO与3a molH2的混合气体在催化剂作用下进行反应②
再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
字母)CD
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△△H2=-556.0kJ•mol-1
③H2O(g)═H2O(l)△△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池
反应为:2CH3OH+3O2+4OH-?2CO32-+6H2O,放电时负极的电极反应方程为:CH3OH-6e-+8OH-=CO32-+6H2O.
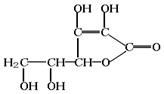
 ,该结构的二氯代物有3种.
,该结构的二氯代物有3种.