题目内容
9.NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
分析 A.依据N=nNA;
B.求出钠的物质的量,然后根据钠元素的化合价变化来分析;
C.碳酸根离子为弱酸根离子,水溶液中部分水解;
D.气体摩尔体积使用对象为气体.
解答 解:A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为2NA,故A错误;
B.2.3g钠的物质的量为0.1mol,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1mol钠失去0.1mol电子,故B正确;
C.1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数小于0.1NA,故C错误;
D.标况下四氯化碳为液体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大,注意气体摩尔体积使用对象和条件.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
13.加热N2O5,依次发生的分解反应为①N2O5(g)?N2O3(g)+O2(g),②N2O3(g)?N2O(g)+O2(g);在2L密闭容器中充入6mol N2O5,加热到t℃,达到平衡状态后O2为8mol,N2O3为3.2mol.则t℃时反应①的平衡常数为( )
| A. | 10.7 | B. | 8.5 | C. | 32 | D. | 64 |
20.某温度下,0.1mol/L NaHS溶液显碱性,则下列关系式或说法中不正确的是( )
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
14.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 向水中通入二氧化硫气 | ||
| C. | 将水加热煮沸 | D. | 向水中加硫酸钠晶体 |
1. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
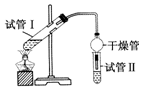
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol•L-1.
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
18.最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.下列关于水的说法中正确的是( )
| A. | 水的离子积仅适用于纯水 | |
| B. | 水的电离需要直流电 | |
| C. | 升高温度水的离子积增大 | |
| D. | 加入电解质一定会破坏水的电离平衡 |
19.下列说法正确的是( )
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |