题目内容
1.密闭容器中进行下列反应:2SO2+O2?2SO3,一段时间后,SO3的浓度增加0.4mol/L,这段时间内v(O2)=0.04mol/(L•s),则这段时间为( )| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
分析 化学反应速率就是化学反应进行的快慢程度,用单位时间内反应物浓度的减少或生成物浓度的增加来表示,物质的量之比等于化学计量数之比.
解答 解:△c(SO3)=0.4mol•L-1,则△c(O2)=$\frac{0.4mol/L}{2}$=0.2mol•L-1,v(O2)=$\frac{△c}{△t}$,故t=$\frac{△c}{v}$=$\frac{0.2}{0.04}$s=5s,
故选C.
点评 本题考查化学反应速率的相关计算,难度不大.把握化学反应速率的定义是解答的关键.

练习册系列答案
相关题目
13.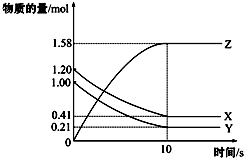 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10 s时,Y的转化率为79.0% | |
| D. | 在前10 s内用X、Y、Z表示的反应速率数值相等 |
10.现有部分前四周期元素的性质或原子结构如表:
(1)写出元素E+基态原子的电子排布式:1s22s22p63s23p63d10.
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
(2)ABCD四种元素电负性由大到小排列顺序为(用元素符号表示)O>N>C>Si
(3)B单质分子中,含有σ键和π键的个数比是1:2,元素C的气态氢化物的杂化方式和空间构型分别为sp3、V形.
(4)以上元素组成的化合物中心原子是sp杂化方式的是CO2(化学式)
(5)A、B、C、D第一电离由大到小的顺序为(用元素符号表示):N>O>C>Si.
11.下列递变情况中正确的是( )
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |

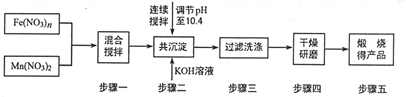 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).