题目内容
13.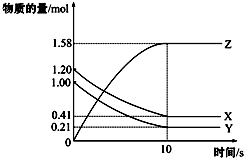 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10 s时,Y的转化率为79.0% | |
| D. | 在前10 s内用X、Y、Z表示的反应速率数值相等 |
分析 根据图象的曲线变化判断物质的量的变化以及反应速率、转化率的计算,根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.395mol/L,故B错误;
C.反应开始到10s时,Y的转化率为$\frac{1.0mol-0.21mol}{1.0mol}$×100%=79%,故C正确;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到3min时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,所以在前10 s内用X、Y、Z表示的反应速率数值不相等,故D错误;
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,注意分析图象中各物理量的变化曲线,把握相关物理量的计算.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
4.按原子半径增大的顺序排列的一组是( )
| A. | Be、N、F | B. | Mg、Si、C | C. | Na、Mg、Ca | D. | Cl、S、P |
1.密闭容器中进行下列反应:2SO2+O2?2SO3,一段时间后,SO3的浓度增加0.4mol/L,这段时间内v(O2)=0.04mol/(L•s),则这段时间为( )
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
8.下列有关说法正确的是( )
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COOH 溶液加水稀释后,溶液中C(OH-)减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
18.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
5.以氯乙烷为原料制备1,2-二溴乙烷,下列方案中合理的是( )
| A. | CH3CH2Cl$→_{H_{2}O}^{NaOH}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Cl$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
3.下列各组指定原子序数的元素,能形成AB2型离子化合物的是( )
| A. | 6和8 | B. | 16和8 | C. | 12和9 | D. | 11和6 |
