题目内容
19.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-10,则该溶液可能是( )①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
分析 常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,c(H+)=c(OH-)=10-5mol/L,水的电离被促进.而酸、碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用.据此分析.
解答 解:①H2SO4对水的电离有抑制作用,故错误;
②CH3COOH是酸,对水的电离有抑制作用,故错误;
③NH4Cl是强酸弱碱盐,在溶液中会水解,对水的电离有促进作用,故正确;
④KOH是碱,对水的电离有抑制作用,故错误;
⑤CH3COONa是强碱弱酸盐,在溶液中会水解,对水的电离有促进作用,故正确.
故选D.
点评 本题考查了水电离平衡的影响因素分析判断,注意酸碱抑制水的电离,水解的盐促进水的电离,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
9.对于可逆反应M+N?Q 达到平衡时,下列说法中,正确的是( )
| A. | M、N全部变成了Q | |
| B. | M、N、Q三种物质的浓度一定相等 | |
| C. | 反应已经停止 | |
| D. | 反应混合物各成分的百分组成不再变化 |
10.下列说法中不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水洗,边洗边眨眼睛 | |
| B. | 不慎将少量浓硫酸沾到皮肤上,应立即用大量水洗,然后涂上硼酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布扑灭 |
7.下列物质反应时,反应物用量或反应条件的改变对生成物无影响的是( )
| A. | C和O2 | B. | Na2CO3和盐酸 | C. | Na和O2 | D. | NaHCO3和NaOH |
11.下列有关物质的性质与应用不相对应的是( )
| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
8.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、图乙所示.下列说法正确的是( )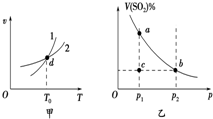

| A. | 图甲中,曲线1表示正反应速率和温度的关系,曲线2表示逆反应速率与温度的关系 | |
| B. | 图乙中,温度恒定时,a、b两点对应的反应速率:va>vb | |
| C. | 图甲中,d点表示温度为T0时,反应已经达到平衡 | |
| D. | 图乙中,温度恒定时,c点的反应正在向正反应方向进行 |
9.下列叙述符合平衡移动原理的是( )
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |